عرفنا من مواضيع سابقة ان القانون الثاني للديناميكا الحرارية; المعروف باسم ( قانون الانتروبيا) يؤدي في كثير من الاحيان الى التغيرات التي تنطوي على عدم المساواة. ففي الحديث عن مبادئ كارنو اثبتنا ان المحرك الحراري اللا انعكاسي اقل كفاءة من نظريه الانعكاسي اذا كان يعملان بين نفس خزاني الطاقة. وهناك تفاوت اخر مهم في علم الترموديناميك ويرتبط بالقانون الثاني. وهناك مفهوم اخر ارتبط بالقانون الثاني, ففي عام 1865 قدم عالم الفيزياء الالماني رودولف كلاوسيوس ( Rudolf Clausius) مصطلح الاعتلاج, او ما يعرف بالانتروبيا, من خلال الصيغة التالية:
حيث T هي درجة الحرارة وQ مقدار الطاقة الحرارية وS مقدار الإنتروبي. واضاف كالوسيوس ايضا ان ارتفاع وانخفاض قيمة الانتروبيا مرتبط دائما بارتفاع وانخفاض الحرارة, فكلما ارتفعت الحرارة في النظام ارتفعت معها الانتروبيا وبسحب الحرارة منه تنخفض الانتروبيا.
ما هي الانتروبيا؟
ويتضح من ذلك ان الانتروبيا خاصية مفيدة وتعمل كاداة لتحليل القانون الثاني في الانظمة الهندسية. لكن هذا لا يعني اننا نعرف ونفهم الانتروبيا جيدا, بل في الواقع لا يمكننا اعطاء اجابة مناسبة على السؤال: ما هي الانتروبيا؟
ولكن ذلك لا يعني اننا نستسلم ولا نبحث عن حقيقة الانتروبيا. فنحن ايضا لم نتمكن من ايجاد جواب مناسب على سؤال ما هي الطاقة, ولكن هذا الامر لم يؤثر في مسألة الوصول الى مستويات مبهرة في ابحاث الطاقة. واذا كان الفارق ان الانتروبيا ليست بالمصطلح الدارج استخدامه في حياتنا اليومية كما في الطاقة, فانه مع الاستخدام المستمر سيتعمق فهمنا لهذا المصطلح وستنمو قدراتنا في التعامل معه. وفي هذا الموضوع سنلقي بعض الضوء على المعنى الفيزيائي للانتروبيا.
يمكن النظر الى الانتروبيا على انها مقياس لاضطراب الجزئيات, فعندما يصبح النظام اكثر اضطرابا تصبح التنبؤ بمواقع الجزئيات اكثر صعوبة وحينها تزداد الانتروبيا. وبالتالي فانه ليس من المستغرب ان تكون المواد الصلبة في مستوى ابعد عن الانتروبيا, وتكون المواد الغازية الاقرب اليها. ففي حالة المواد الصلبة تتأرجح الجزئيات باستمرار حول مواضع توازنها, ولكنها لا تستطيع ان تنتقل حول بعضها البعض. وعليه فانه من السهل توقع موضعها في اي لحظة.
ولكن في الحالة الغازية فان الجزئيات تتحرك بشكل عشوائي وتصطدم ببعضها البعض وتغير اتجاه حركتها باستمرار, مما يجعل التنبؤ بموضعها بدقة امرا في غاية الصعوبة, و ترتبط هذه الفوضى التي تحدثها الجزئيات في الحالة الغازية بقيمة عالية من الانتروبيا.
ومن وجهة نظر الترموديناميكا الإحصائية فان النظام المعزول الذي يبدو انه في حالة توان يُظهِر في الواقع مستوى عالٍ من النشاط بسبب الحركة المستمرة للجزئيات. وبسبب هذه الحركة وتصادم الجزئيات مع بعضها البعض فانها تتوزع بشكل عشوائي ويكون لدينا اكثر من احتمال لاماكن تواجدها. وقد صاغ الفيزيائي النمساوي لودفيغ بولتزمان (Ludwig Boltzmann) القانون التالي: S=k.lnW
حيث ان k هو ثابت لتوزمان, ويشير W الى احتمال حالة خاصة من النظام, وهو رمز مأخوذ من اللغة الكلمة الالمانية ( Wahrscheinlichkeit) والتي تعني (احتمال).
فمن وجهة نظر ميكروسكوبية فان الانتروبيا تزداد في النظام كلما ازدادت العشوائية او الاضطراب الحراري في النظام. وهكذا, يمكن النظر الى الانتروبيا على انها مقياس للعشوائية الحرارية او اضطراب الجزئيات, الذي يزداد في اي وقت يمر فيه نظام مغلق بعملية ما.
وكما ذكرنا قبل قليل فان جزئيات المادة تتأرجح باستمرار في الحالة الصلبة, مما يخلق حالة من عدم اليقين بشأن موقعها. ومع ذلك فان هذا التأرجح يتلاشى مع انخفاض درجة الحرارة, وافتراضات تصبح الجزئيات بلا حركة عند الصفر المطلق, وهذا هو الحد الادنى من الطاقة. لذلك فان الانتروبيا في مادة نقية, كالكريستال, تكون صفرا عند درجة حرارة الصفر المطلق حيث لا يوجد اي شك حول حالة الجزئيات وموقعها في تلك اللحظة. وهذا هو القانون الثالث من قوانين الترموديناميك, ويُعرف باسم ( الصفر المطلق).
ويوفر القانون الثالث للديناميكا الحرارية نقطة مرجعية لتحديد الانتروبيا. ان الانتروبيا المحددة بالنسبة لهذه النقطة تدعى الانتروبيا المطلقة, وهي مفيدة للغاية في التحليل الديناميكي الحراري للتفاعلات الكيميائية.
تمتلك الجزئيات في الطور الغازي كمية كبيرة من الطاقة الحركية, ومع ذلك فهي غير كافية لانتاج الجهد. وذلك لان جزئيات الغاز وما تحمل من طاقة تكون غير منتظمة , ولها قابلية ان تعمل باي اتجاه كان. فربما عدد الجزئيات الذي يحاول تدوير عجلة ما يساوي نفس عدد الجزئيات التي تدفع بالعجلة الى الاتجاه المعاكس, مما يؤدي الى ان تبقى العجلة بلا حراك. ولذلك فان الطاقة غير المنتظمة لا تكون مفيدة ولا يمكن تحويلها لعمل بشكل مباشر.
رسم توضيحي للطاقة غير المنتظمة باتجاه معين. الرجال في الصورة يمثلون الطاقة.
الحرارة , في جوهرها, شكل من اشكال الطاقة غير المنتظمة, كما ان بعض الانتروبيا عادة ما تتدفق مع الحرارة. وكنتيجة لذلك فان الانتروبيا ومستوى الاضطراب الجزئيي للجسم الساخن يتناقصان في الجسم الساخن في نفس الوقت التي ترتفع فيه كمية الانتروبيا ومستوى الاضطراب الجزيئي في الجسم البارد. وينص القانون الثاني على ان زيادة الانتروبيا في الجسم البارد اكبر من كمية انخفاضها في الجسم الساخن. وذلك ذلك يعني ان النظام المدمج ( اي بارد وساخن) يكون في حالة اضطراب كبيرة في وضعه النهائي, مما يعني ان العمليات يمكن ان تحدث فقط في اتجاه زيادة مستوى الاضطراب.
الانتروبيا في الحياة اليومية
وبالرغم من ان الانتروبيا قابلة للتطبيق بسهولة على مختلف جوانب الحياة اليومية, الا اننا لا نستخدم هذا المفهوم مثل استخدامنا لمفهوم الطاقة. وكمثال من مجالات استخدام مصطلح الانتروبيا في الحياة اليومية فاننا يمكن ان نقول ان بعض الاشخاص لديهم مستوى منخفض من الانتروبيا بسبب تنظيمهم لحياتهم, فهم لديهم مكان لكل شئ بما يوفر الحد الادنى لعدم اليقين ويستهلكون مقدارا ضيئلا من الطاقة لتحديد اماكن لوازمهم الشخصية.
ومن ناحية اخرى فان الاشخاص غير المنظمين يعيشون بمستوى عالٍ من الانتروبيا, ويستهلكون وقتا طويلا للعثور على اغراضهم, ومن المحتمل ان يخلقوا اضطرابا اكبر اثناء بحثهم عن الاشياء حيث من المرجح انهم سيجرون البحث بطريقة غير منتظمة.
مستوى منخفض من الانتروبيا
مستوى مرتفع من الانتروبيا
والان عزيزي القارئ, ماذا عن مستوى الانتروبيا في حياتك اليومية؟ هل هو مرتفع ام منخفض؟
هل يمكنك ان تلتقط لنا صورة من غرفتك او مكتبك؟
مواضيع ذات صلة:
- الصفر الطلق ( من اعداد رجل كهل)
- القانون الثاني للديناميكا الحرارية
- مبادئ كارنو
- عمليات الديناميكا الحرارية غير القابلة للانعكاس
لانجاز هذا الموضوع تمت الاستعانة ببعض المواقع العلمية وبعض الكتب الهندسية, اهمها كتاب (Thermodynamics) تأليف ( Cengel & Boles)





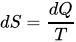



 رد مع اقتباس
رد مع اقتباس