بيريدين
مركب كيميائي من المركّبات العطرية الحلقية غير المتجانسةالبَيريدِين (أو البايريدين، ويرمز له اختصاراً Py) هو مركّب عضوي صيغته الكيميائية C5H5N وهو من المركّبات العطرية الحلقية غير المتجانسة. تتكوّن بنية البيريدين من حلقة سداسية غير مشبعة حاوية على ذرّة نيتروجين، وتوجد هذه الحلقة في بنية عددٍ من المركّبات المهمّة، متضمّنةً الآزينات وغيرها مثل النياسين والبيريدوكسينوآيزونيازيد والنيكوتين.[3]
بيريدين التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية Pyridine[1] تسمية الاتحاد الدولي للكيمياء Azinine أسماء أخرى Azine
Azabenzeneالمعرفات الاختصارات Py رقم CAS 110-86-1 بوب كيم 1049 مواصفات الإدخال النصي المبسط للجزيئات
- C1=CC=NC=C1[2]
المعرف الكيميائي الدولي
- 1S/C5H5N/c1-2-4-6-5-3-1/h1-5H[2]
InChIKey:JUJWROOIHBZHMG-UHFFFAOYSA-N[2]الخواص صيغة جزيئية C5H5N الكتلة المولية 79.101 غ/مول المظهر سائل عديم اللون الكثافة 0.98 غ/سم3 نقطة الانصهار - 41.6 °س نقطة غليان 115.2 °س الذوبانية في ماء يمتزج مع الماء المخاطر ترميز المخاطر F
Xn
توصيف المخاطر R11-R20/21/22 تحذيرات وقائية S2-S26-S28 في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) تعديل
يعدّ البيريدين من المركّبات الطليعية التي يبنى عليها في تشكيل مركّبات كيميائية أخرى في عددٍ من المجالات الصناعية التطبيقية مثل الكيمياء الزراعية وصناعة الدواء. يستخدم البيريدين في الصناعة مذيباً وكاشفاً كيميائياً؛ وكذلك في اصطناع الحمض النووي الريبوزي منقوص الأكسجين (DNA) في المختبر.[4].
تاريخياً كان البيريدين يستحصل من قطران الفحم وكناتج ثانوي من عملية تغويز الفحم؛ إلّا أنّ ازدياد الطلب عليه أدّى إلى تطوير تفاعلات اصطناع عضوي من مركّبات بسيطة مثل الأسيتالدهيد والأمونياك. يُنتج سنوياً أكثر من 20 ألف طنّ من المركّب في مختلف أرجاء العالم.
التاريخعدل
توماس أندرسون
عُرف البيريدين غير النقي من الخيميائيين القدماء غالباً، وذلك بتسخين عظام الحيوانات والمواد العضوية الأخرى؛[5]إلّا أنّ اكتشافه ينسب إلى العالم الكيميائي توماس أندرسون.[6][7] اكتشف أندرسون البيريدين سنة 18499 أثناء فحصه محتويات الزيت المستحصل من تسخين عظام الحيوانات لدرجات حرارة مرتفعة؛[7] فقام بدراسة خواصه، ونظراً لقابلية المركّب للاشتعال أسماه pyridine من السابقة الإغريقية πῦρ (پير) بمعنى: نار؛ واللاحقة idineإيدين، والتي أضيفت للتوافق آنذاك مع تسمية المركّبات الكيميائية الحاوية على ذرة نتروجين، مثل مركّبالتوليدين.[8] حُدّدت البنية الكيميائية للبيريدين في عقود تلت بعد اكتشافه، حيث حاول الكيميائيون معرفتها بالوسائل المتاحة لديهم آنذاك؛ فاقترح فيلهلم كورنر سنة 1869،[9] و جيمس ديوار سنة 1871 [10][11] أنّ البنية مشتقّة من البنزين بوجود ذرّة نتروجين محلّ وحدة C–H في الحلقة، كما هو وجه الشبه في حالة الكينولينوالنفثالين.[12][13] جرى تأكيد هذا الاقتراح لاحقاً بأسلوب تجريبي عند اختزال المركّب إلى بيبريدين باستخدامالصوديوم في الإيثانول.
قام وليام رامزي في سنة 1876 بتحضير البيريدين مخبرياً من مفاعلة الأسيتيلين مع سيانيد الهيدروجين في فرن حراري؛ وكانت تلك العملية أوّل اصطناع عضوي مخبري لمركّب حلقي غير متجانس.[14][15] إلّا أنّ المحاولات المتتالية للحصول على البيريدين بوسائل أكثر كفاءة أدّت إلى تطوير عددٍ من التفاعلات الانتقائية. وهذا ما توصّل إليه العالم الروسي أليكسي تشيشيبابين سنة 19244 عندما تمكّن من تطوير تفاعل اصطناع للبيريدين اعتماداً على كواشف كيميائية منخفضة الثمن؛[16] ولا يزال هذا الأسلوب مستخدماً لتحضير هذا المركّب.[17]
التسمية الكيميائيةعدل
وفق نظام تسمية هانتش-فيدمان والموصى بها من الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPACC) فإنّ التسمية النظامية للبيريدين هي "آزين"؛ إلّا هذه التسمية النظامية نادراً ما تستخدم مثلما هو أغلب الحال مع أغلب المركّبات العضوية البسيطة. ولذلك ووفق مراجعات IUPAC فإنّ استخدام آزين غير محبّذ حالياً وذلك لصالح استخدام تسمية "بيريدين".[18]
يبدأ ترقيم الحلقة انطلاقاً من ذرّة النتروجين، وتُرمّز ذرّات الكربون بالأرقام وفق ذلك أو باستخدام السوابق وفق نمط الاستبدال في الحلقات العطرية: أورثو وميتا وبارا أو في بعض الأحيان باستخدام أحرف الأبجدية اليونانية (α-γγ). وفقاً لما سبق فإنّ ذرة الكربون ألفا α (أورثو) وبيتا β (ميتا) وغاما γ (بارا) تشير إلى الذرّات ذات الأرقام 2 و 3 و 4 على الترتيب.
يطلق على مشتقّ البيريدين اسم بيريدينيل، بحيث يشار إلى موقع الاستبدال برقم محدّد، مع العلم أنّ المشتقّ يشار إليه في بعض الأحيان بيريديل وفقاً لتوصيات IUPAC.[19]يسمّى الكاتيون الناتج عن إضافة كاشف محب للإلكترون(إلكتروفيلي) إلى ذرّة النتروجين بيريدينيوم.
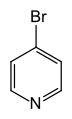
4-برومو البيريدين
2،′2-بيبيريدين
بيريدين-6،2-ثنائي حمض الكربوكسيليك (ثنائي حمض البيكولينيك)
الصيغة العامّة لكاتيون البيريدينيوم
الوفرة الطبيعيةعدل
يحوي نبات ستّ الحسن على البيريدين
البيريدين مركّب غير واسع الانتشار في الطبيعة، لكنّه يوجد في أوراق وجذور بعض النباتات مثل ستّ الحسن (الاسم العلمي: Atropa belladonna)،[20] وفي الختمية الطبّية(الاسم العلمي: Althaea officinalis).[21]
يشكّل البيريدين، ولكن بكمّيّات نزرة، جزءاً من مكوّناتالمركّبات العضوية المتطايرة الناتجة عن بعض عمليات المعالجات الغذائية للأطعمة والأطباق؛ مثل الدجاج المقلي،[22] وسوكياكي،[23] والقهوة المحمّصة،[24] ورقائق البطاطا المقلية،[25] ولحم الخنزير المقدّد المقلي.[26] يوجد آثار من البيريدين كذلك في جبنة بوفور،[27] والشاي الأحمر،[28] وبعض أنواع العسل.[29] أمّا في جسم الإنسان فيوجد ضمن تركيب الإفرازات المهبلية،[30] وفي لعاب من يعانون من التهاب اللثّة.[31] عثر على آثار من البيريدين أيضاً في دخان التبغ،[32][33] والمرجوانا.[14]
الإنتاج والتحضيرعدل
تاريخياً كان البيريدين يستحصل من قطران الفحم أو على شكل ناتج ثانوي من عملية تغويز الفحم، إلا أن تلك العمليات كانت مضنية وذات كفاءة متدنّية، إذ أنّ قطران الفحم يحوي البيريدين بنسبة 0.1% فقط؛[34] ممّا كان يتطلّب عمليّات تنقية متعدّدة المراحل، والتي كانت تقللّ من المردود بشكل إضافي. يستحصل على البيريدين حالياً بأساليب صناعية تقنية اعتماداً على تفاعلات كيميائية منسوبة إلى أسماء مكتشفيها،[17] كما هو موضّحٌ أدناه.
اصطناع تشيشيبابينعدل
ينسب تفاعل الاصطناع هذا إلى مكتشفه العالم أليكسي تشيشيبابين الذي نشره أوّل مرّة سنة 19244، ولا يزال مستخدماً في الصناعة.[16] يصنّف هذا التفاعل كيميائياً على أنّه تفاعل تكاثف بين الألدهيدات أو الكيتونات أو أيّ مركّب من مركّبات الكربونيل α،ββ-غير المشبعة أو أيّ مزيج ممّا سبق مع الأمونياك أو الأمينات.[35] يستخدم هذا النموذج لتحضير البيريدين ومشتقّاته، أمّا لتحضير البيريدين غير المستبدل، فيستخدم لذلك الفورمالدهيد أوالأسيتالدهيد.
تشكّل الأكرولين من الفورمالدهيد والأسيتالدهيد
تشكّل البيريدين من الأكرولين والأسيتالدهيد
تتمّ آلية التفاعل وفق الخطوات التالية: يتشكّل أوّلاًالأكرولين وفق تكاثف ألدولي بين الفورمالدهيد والأسيتالدهيد. يتكاثف الأكرولين بدوره مع الأسيتالدهيد والأمونيا إلى ثنائي هيدرو البيريدين، ومن ثمّ يحوّل الأخير بعملية أكسدة، غالباً حفزية، إلى البيريدين. تجرى العملية في الطور الغازي عند درجات حرارة تتراوح بين 400–450 °س؛ ويتألّف الناتج من مزيجٍ من البيريدين وعددٍ من المركّبات الثانوية مثل بيكولين و6،2-لوتيدين. على العموم يعتمد تركيب المزيج على نوع الحفاز المستخدم؛ وعادةً ما تستخدم حفّازات من أملاح الفلزّات الانتقالية مثل فلوريد الكادميوم أو فلوريد المنغنيز الثنائي، بالإضافة إلى مركّباتالكوبالت والثاليوم. يفصل البيريدين كناتج أساسي عن النواتج الثانوية بعمليّات تنقية متعدّدة المراحل.[17] لا يعدّ أسلوب اصطناع تشيشيبابين للبيريدين ملائماً للتطبيقات الصناعية بشكل كبير، بسبب المردود الضعيف (حوالي 200%)، ممّا جعل من التفاعل على شكله غير المعدّل من أساليب التحضير غير الشائعة.[35]
نزع الألكيل من ألكيلات البيريدينعدل
يحضّر المركب أيضاً بإجراء تفاعل نزع ألكيل من ألكيلات البيريدين، وهي مركّبات تنتج ثانوياً من عمليّات صناعية مختلفة. تجرى مثلاً عملية نزع ألكيل تأكسدية إمّا باستخدام أكسجين الهواء على حفّاز من أكسيد الفاناديوم الخماسي V2O5،[36] أو على حفّاز من النيكل في الطور البخاري،[37][38] أو الألكلة المهدرجة باستخدام حفّازات منالفضة أو البلاتين.[39] يمكن أن يصل مردود هذا الأسلوب من التفاعلات إلى 933%، كما هو الحال عند استخدام حفّازات النيكل على سبيل المثال.[17]
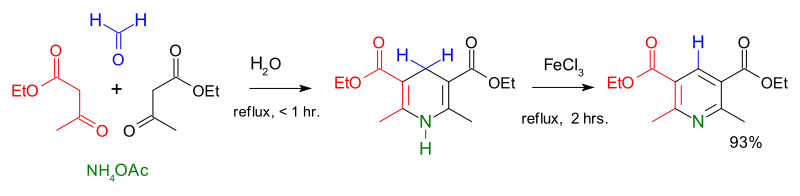
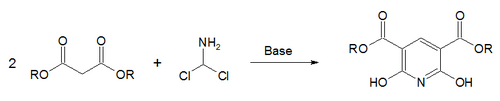
اصطناع هانتش للبيريدينعدل
وصف أوّل اصطناع لمشتقّات البيريدين من الكيميائي آرثر رودولف هانتش سنة 1881،[40] ولذلك ينسب إليه تفاعلاصطناع هانتش للبيريدين، والذي يستخدم فيه مزيج من β-حمض كيتو (غالباً أسيتو الأسيتات) وألدهيد (غالباًفورمالدهيد) والأمونياك أو أحد أملاحه كمانح نتروجيني. يحصل في البداية على ثنائي هيدرو البيريدين، والذي يتأكسد لاحقاً إلى مشتقّات البيريدين الموافقة. أوضح الكيميائي إيميل كنوفيناغل أنّه بالإمكان الحصول على مشتقّات البيريدين غير متناظرة الاستبدال وفق هذه العملية.[41]
اصطناع هانتش للبيريدين باستخدام أسيتو الأسيتات والفورمالدهيدوأسيتات الأمونيوم بوجود كلوريد الحديد الثلاثي بدور مؤكسد.
تحلّق بونيمانعدل
يمكن تحضير البيريدين من إجراء تفاعل تحلّق ثلاثي الأركان، تتألّف مكوّناته من قسم من جزيء نتريل مع وحدتين من الأسيتيلين؛ ويدعى هذا التفاعل "تحلّق بونيمان"، وهو من حيث المبدأ تحوير لتفاعل اصطناع ريبه، ويمكن تنشيطه إما حرارياً أو ضوئياً. يتطلب التنشيط الحراري استخدام شروط قاسية، في حين أنّ تفاعلالإضافة الحلقية المنشّط ضوئياً يتمّ ضمن شروط معتدلة، حتى في الأوساط المائية، باستخدام حفّاز من معقد 5،1-حلقي الأوكتاديين (cod) مع الكوبالت (CoCp2(cod.[42] يمكن وفق هذه الطريقة تحضير سلسلة من مشتقّات البيريدين، فعلى سبيل المثال عند استخدام أسيتونتريليحصل على 2-ميثيل البيريدين، والذي يستحصل منه على البيريدين بعملية نزع ألكيل.
أساليب أخرىعدل
- يعطي تفاعل اصطناع كرونكه وسيلة عامّة لتحضير مشتقّات البيريدين المستبدلة انطلاقاً من البيريدين نفسه. في هذا التفاعل تتمّ مفاعلة البيريدين مع α-بروموإستر ألكيلي ليتشكّل ملح بيريدينيوم، تكون فيهمجموعة الميثيلين ذات صفة حمضية قوية، ممّا يؤدي إلى حدوث تفاعل إضافة شبيه بتفاعل مايكل مع مركّبات الكربونيل α،β-غير المشبعة بوجود أسيتات الأمونيوم، حيث يحدث تفاعل إغلاق للحلقة وتشكّل للبيريدين المستبدل بالإضافة إلى بروميد البيريدينيوم.[43]
- انطلاقاً من البيرول يحدث تفاعل إعادة ترتيب عند المفاعلة مع ثنائي كلورو الكربين للحصول على 33-كلورو البيريدين.[44][45][46]
- كما يمكن الحصول على مشتقّات البيريدين انطلاقاً من تفاعل إستر المالونات مع ثنائي كلورو ميثيلامين؛[47] في تفاعل يسمى اصطناع غاترمان-سكيتا.[48]
التخليق الحيويعدل
يوجد النياسين، وهو من مشتقّات البيريدين (بيريدين-3-حمض الكربوكسيليك)، في عددٍ من الكائنات الحية. فعلى سبيل المثال تنتِج المتفطّرة السلّيّة (الاسم العلمي:Mycobacterium tuberculosis) والإشريكيّة القولونيّة(الاسم العلمي: Escherichia coli) حمض النيكوتينيك من تكاثف 3-فوسفات غليسيرالدهيد مع حمض الأسبارتيك.[49]
الخواصعدل
الخواص الفيزيائيةعدل
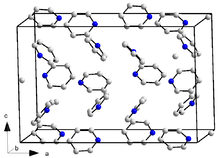
البنية البلورية للبيريدين
في الشروط القياسية من الضغط ودرجة الحرارة يوجد البيريدين على شكل سائل عديم اللون يغلي عند الدرجة 115.2 °س ويتجمّد عند −41.6 °س؛ أمّا كثافته فمقدارها 0.9819 غ/سم3 وهي قريبة من كثافة الماء؛ في حين أنّمعامل الانكسار هو 1.5093 عند طول موجة 589 نانومترودرجة حرارة 20 °س.[50] تؤدّي إضافة الماء إلى البيريدين بنسبة 40 مول% إلى تخفيض نقطة انصهاره من −−41.6 °س إلى −65.0 °س.[51] للبيريدين مغناطيسية معاكسةوتبلغ القابلية المغناطيسية له −48.7 × 10−6 سم3·مول−1؛[52] في حين تبلغ قيمة عزم ثنائي القطب قيمة مقدارها 2.2 ديباي.[53] الحرارة القياسيةلتكوين البيريدين هي 100.2 كيلوجول.مول −1 في الطور السائل،[54] في حين أنّها 140.4 كيلوجول.مول −1 في الطور الغازي. عند 25 °س للبيريدين لزوجة مقدارها 0.88 ميلي باسكال.ثانية؛[55] وناقلية حرارية مقدارها 0.166 واط.متر−1·كلفن−1؛[56][57] أمّا حرارة التبخر فهي 35.09 كيلوجول.مول−1 عند نقطة الغليان تحت الضغط العادي،[58]في حين أنّ حرارة الانصهار هي 8.28 كيلوجول.مول−1عند نقطة الانصهار.[59]
يتبلور البيريدين وفق نظام بلوري معيني قائم وتكون لهالزمرة الفراغية Pna21، أمّا أبعاد الشبكة البلوريةبالبيكومتر فهي a = 1752 و b = 897 و c = 11355؛ بحيث يكون هناك 16 وحدة صيغة لكلّ وحدة خلية(مقيسة عند 153 كلفن). للمقارنة فإنّ البنزين يتبلور وفق النظام البلوري المعيني القائم أيضاً وله الزمرة الفراغيةPbca وأبعاد الشبكة البلورية بالبيكومتر هي a = 729.22 و b = 947.1 و c = 674.2 (مقيسة عند 788 كلفن)؛ إلّا أنّ عدد الجزيئات لكل خلية هو 4 فقط.[60] يعود هذا الاختلاف جزئياً إلى انخفاض قيمة التناظر في جزيئات البيريدين (C2v) مقارنة مع البنزين (D6h). للبيريدين شكل مائي على هيئة ثلاثي هيدرات (py·3H2O)، وهو يتبلور وفق النظام البلوري المعيني القائم أيضاً، ولكن بالزمرة الفراغية Pbca، بحيث أنّ أبعاد الشبكة البلورية لها القيم التالية بالبيكومتر: a = 1244 و b = 1783 و c = 679؛ مع إمكانية وجود 8 وحدات صيغة لكل وحدة خلية (مقيسة عند 223 كلفن).[51]
تبلغ قيم النقط الحرجة للبيريدين 6.70 ميغاباسكال بالنسبة للضغط، و 6200 كلفن بالنسبة لدرجة الحرارة؛ في حين أنّ الحجم الحرج يبلغ 229 سم3·مول−1.[61] يعبّر عن ضغط البخار p للبيريدين في مجال من درجة الحرارة بين 3400–426 °س وفق معادلة أنطوان:
{\displaystyle \log _{10}p=A-{\frac {B}{C+T}}}
حيث T درجة الحرارة، أما A و B و C ثوابت قيمتها 4.16272 و 1371.358 و −58.496 على الترتيب.[62]
يحوي طيف الامتصاص للبيريدين في الهكسان على ثلاث حزم عند أطوال الموجة 195 نانومتر (توافق الانتقال **π → π وامتصاصية مولية ε = 7500 لتر.مول−1·سم−1) وعند 251 نانومتر (توافق الانتقال *π → π وامتصاصية مولية ε = 2000 لتر.مول−1·سم−1) وعند 270 نانومتر (توافق الانتقال *n → π وامتصاصية مولية ε = 450 لتر.مول−1·سم−1).[63] أمّا طيف الرنين المغناطيسي النووي1H NMR للمركّب فله ثلاث إشارات (قمم) لها نسبة شدّة تكاملية 22 وهي توافق البرتونات الثلاثة المختلفة كيميائياً في بنية الجزيء؛ إذ أنّ الجزيء يحوي بروتوناتألفا α في المواقع 2 و 6 (ذات انزياح كيميائي 8.5 ppmm) و بروتونات بيتا β في المواقع 3 و 55 (ذات انزياح كيميائي 7.1 ppm) و برتونات γ في الموقع 4 (ذات انزياح كيميائي 7.5 ppm). أمّا طيف 13C NMR للبيريدين فيظهِر قمّة ثلاثية الرؤوس عند δ(α-C) = 150 ppm و δ(β-C) = 124 ppm و δ(γ-C) = 136 ppm. جميع قيم الانزياح الكيميائي منسوبة إلى قياسات للمادّة خالية من المذيبات.[64] يمكن استخدام وسائل تحليلية أخرى للكشف عن البيريدين مثل الاستشراب الغازي ومطيافية الكتلة.[14]
الخواص الكيميائيةعدل
يصنّف البيريدين كيميائياً من المركّبات الحلقية غير المتجانسة العطرية وله صفة قاعدية ضعيفة. يمتزج البيريدين مع الماء ومع أغلب المذيبات العضوية.[50] يشكّل البيريدين مع حمض الهيدروكلوريك ملح هيدروكلوريدينصهر بين 145–147 °س.[65] يتصرّف البيريدين فيالتفاعلات العضوية مثل الأمينات الثالثية، وهو يخضع لتفاعلات كيميائية متعدّدة مثل البرتنة والألكلة والأسيلةوالأكسدة الأمينية على ذرّة النتروجين؛ كما أنّه يخضعلتفاعلات الاستبدال المحبّة للنواة (النكليوفيلية) بصفته من المركّبات العطرية.
بسبب وجود ذرة النتروجين ذات الصفة الكهرسلبية في حلقة البيريدين فإنّ الجزيء يعاني نسبياً من نقص إلكتروني، ولذلك فهو لا يخضع لتفاعلات الاستبدال العطرية المحبة للإلكترونات (الإلكتروفيلية) بنفس السهولة التي تبرزها حلقة البنزين على سبيل المقارنة؛ وخاصّة إذا لم يتوفّر في مزيج التفاعل ما يسحب البروتونات المتحرّرة من التفاعل (إذ أنّ البيريدينيوم يعاني من نقص إلكتروني أكبر). بالمقابل؛ فإنّه وعلى العكس من البنزين ومشتقّاته فإنّ البيريدين أكثر عرضةً لتفاعلات الاستبدال المحبّة للنواة (النكليوفيلية)، ولتفاعلات فلزنة (إضافة فلز وتكوين مركب عضوي فلزي) على الحلقة باستخدام قواعد عضوية فلزّية قويّة.[66][67] يمكن تصنيف تفاعلية البيريدين حسب الكواشف الكيميائية المستخدمَة إلى ثلاث مجموعات كيميائية: مع الكواشف المحبّة للإلكترون (الإلكتروفيلية) يحدث تفاعل استبدال محب للإلكترون (إلكتروفيلي) بحيث يظهر البيريدين صفاته العطرية؛ أمّا مع الكواشفالمحبّة للنواة (النكليوفيلية) فيتفاعل البيريدين في الموقعين 2 و 4 بشكل شبيه للإيمينات؛ أمّا التفاعل معأحماض لويس فيؤدّي إلى حدوث تفاعل إضافة على ذرّة النتروجين بشكل شبيه بالأمينات الثالثية، مثل قابلية البيريدين للأكسدة الأمينية (تشكيل أكسيد الأمين).[68]
يوجد زوج إلكتروني حر على ذرة النتروجين في البيريدين.
تحمل ذرّة النتروجين في البيريدين زوج غير رابط (زوج حرّ) من الإلكترونات، وبسبب أنّ هذا الزوج ليس جزءاً من عطرية حلقة البيريدين، يتّصف المركّب بصفات قاعدية، وذلك بشكل شبيه بالأمينات الثالثية. تبلغ قيمة ثابت تفكّكpKa الحمض المرافق (كاتيون البيريدينيوم) 5.255؛ حيث يمكن برتنة البيريدين بالتفاعل مع الأحماض لتشكيل كاتيون البيريدينيوم، وهو أيون متعدّد الذرّات، يكون فيه طول الروابط والزاويا بينها مماثلاً بشكل كبير للقيم في البيريدين؛[69] كما أنّ هذا الكاتيون متساو ٍإلكترونياً مع البنزين.
يعدّ البيريدين ربيطة ضعيفة نسبياً في تشكيل المعقّدات التناسقية مع أيونات الفلزّات الانتقالية؛ فعلى سبيل المثال يشكّل معقدات 1:1 مع النيكل الثنائي 2+Ni والنحاسالثنائي 2+Cu بحيث أن قيم ثابت التوازن الكيميائيlog K1 تقع بين 1.9 و 2.6 على الترتيب.[70] درستأطياف الأشعّة تحت الحمراء لمعقّدات البيريدين بشكل مفصّل؛[71][72] كما لوحظ نمط التناسق 6η فقط في المعقّدات ذات الإعاقة الفراغية الكبيرة، بحيث تكون ذرة النتروجين محجوبة فيها.[73]
الخواص الجزيئيةعدل
للمركب نظام مترافق من ستّة إلكترونات باي (π) غير متموضعة وموجودة فوق الحلقة المستوية، وبذلك يصنّف البيريدين من المركّبات العطرية وفق قاعدة هوكل. على العكس من البنزين تكون الكثافة الإلكترونية غير موزّعة بانتظام فوق الحلقة، وبشكل يعكس التأثير الحثّي السلبي لذرّة النتروجين؛ ولذلك السبب فإنّ للبيريدين عزم ثنائي قطب، كما له طاقة ثباتية رنينية (117 كيلوجول.مول−1) أضعف من البنزين (150 كيلوجول.مول−1).[74] لطول الرابطة C–N في حلقة البيريدين قيمة مقدارها 137بيكومتر، بالمقارنة مع 139 بيكومتر للرابطة C–C في المركّب نفسه،[73] وهي القيمة نفسها للرابطة كربون-كربون في البنزين.
لجميع الذرّات في جزيء البيريدين تهجين مداري من النمط2sp، حيث تكون ذرّة النتروجين متضمّنة في النظام π العطري باستخدام مدارات p غير الهجينة، ويكون الزوج غير الرابط في المدار 2sp بحيث يبرز خارجاً عن الحلقة وفي نفس سوية الرابطة سيغما σσ. ولذلك لا يشارك الزوج غير الرابط في النظام العطري، كما أنّ ذرّة النتروجين لا تبدي لذلك أيضاً أيّ تأثير ميزوميري إيجابي.التفاعلات الكيميائيةعدل
مقارنة بين البيريدين مع حلقات عطرية أخرى من حيث طول الرابطة والبنية الجزيئية.
المدارات الإلكترونية في البيريدين
البنى الرنينية للبيريدين
المدارات الإلكترونية في البيريدينيوم
يؤدّي انخفاض الكثافة الإلكترونية في حلقة البيريدين إلى تفضيل حدوث تفاعلات إضافة محبّة للنوى (نكليوفيلية) على ذرة النتروجين بالمقارنة مع تفاعلات الاستبدال المحبة للإلكترون (الإلكتروفيلية). يؤدّي تفاعل الإضافة المحبّ للنوى (النكليوفيلي) على ذرّة النتروجين إلى تعطيل الخواص العطرية وإعاقة حدوث الاستبدال المحب للإلكترون (الإلكتروفيلي). من جهة أخرى فإنّ تفاعلات الاستبدال العطرية المحبّة للنواة (النكليوفيلية) تحدث بشكل أسهل في البيريدين منه في البنزين.[53][66]
تفاعلات الاستبدال المحبّة للإلكترون (الإلكتروفيلية)عدل
إنّ العديد من تفاعلات الاستبدال المحبّة للإلكترونات (الإلكتروفيلية) على البيريدين إما أنّها لا تحدث، أو تحدث بشكل جزئي، ولكن على الرغم من ذلك فإنّ الصفة العطرية غير المتجانسة للحلقة يمكن تفعيلها بإجراء إضافة مجموعة وظيفية مانحة للإلكترونات. ولكن على العموم فإنّ تفاعلات الألكلة والأسيلة (تفاعلات فريدل-كرافتس) المميّزة للبنزين لا تكون ناجحةً على البيريدين، وتؤول إلى تفاعل إضافة على ذرّة النتروجين. تحدث تفاعلات الاستبدال عادة على الكربون رقم 3، وهو أكثر ذرّة كربون غنىً بالإلكترونات في الحلقة، ولذلك تتمّ عليه تفاعلات الاستبدال.
بنية N-أكسيد البيريدين
لا تكون تفاعلات الاستبدال في الموقعين 2 و 4 مفضّلة في الببريدين، لأنّها تؤدّي إلى تشكيل معقّدات σ غير المفضّلة طاقيّاً. ولكن على الرغم من ذلك يمكن تعزيز فرص حدوث الاستبدال في هذين الموقعين بإجراء استبدال إلكتروفيلي على N-أكسيد البيريدين أوّلاً، ثم نزع ذرة الأكسجين من على نتروجين الحلقة. إذ أنّ ارتباط الأكسجين بالنتروجين يقلّل من الكثافة الإلكترونية على ذرّة النتروجين، ممّا يعزّز من فرص حدوث استبدال في الموقعين 2 و 4. يمكن إزالة ذرّة الأكسجين بعدّة وسائل، أكثرها شيوعاً باستخدام مركّبات الفوسفور الثلاثي أو الكبريت الثنائي، والتي يسهل أكسدتها؛ فمثلاً يتأكسد ثلاثي فينيل الفوسفين وفق ما سبق إلى أكسيد ثلاثي فينيل الفوسفين.
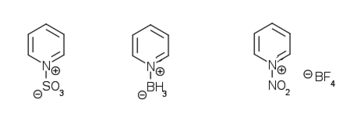
تستلزم نترتة البيريدين بشكل مباشر وجود شروطٍ قاسية، وبالنهاية تعطي مردوداً ضعيفاً. بدلاً من ذلك يمكن الحصول على 3-نترو البيريدين من مفاعلة البيريدين مع خماسي أكسيد ثنائي النتروجين بوجود الصوديوم.[75][76][77] كما يمكن إجراء عملية النترتة باستخدام كاشف رباعي فلوروبورات النترونيوم (NO2BF4) على 6،2-ثنائي برومو البيريدين، ثمّ بإزالة ذرّات البروم.[78][79] أمّا السلفنة المباشرة للبيريدين فهي أصعب من النترتة المباشرة، ولكن بالرغم من ذلك فإنّه من الممكن الحصول على بيريدين-3-حمض السلفونيك بمردود مقبول من غلي البيريدين في فائض من حمض الكبريتيك عند 230 °س.[80] إنّ التفاعل مع مجموعة SO3 تسهّل من إضافة الكبريت إلى ذرّة النتروجين، وخاصّة في وجود حفّاز من كبريتات الزئبق الثنائي.[66][81]
على العكس من تفاعلي النترتة والسلفنة فإنّ تفاعل الهلجنةالمباشرة يتم بشكل جيّد؛ إذ أنّ تفاعل البيريدين مع البرومالجزيئي في حمض الكبريتيك عند الدرجة 1300 °س يعطي 3-برومو البيريدين بشكل فوري، ويكون مردود التفاعل في هذه الحالة أكبر من تفاعل الكلورة المباشر باستخدام الكلورالجزيئي في وجود حفّاز من كلوريد الألومنيوم عند الدرجة 100 °س. يمكن الحصول على 2-برومو البيريدين و 22-كلورو البيريدين من التفاعل المباشر مع الهالوجين الموافق بوجود حفّاز من كلوريد البالاديوم الثنائي.[82]
أمثلة على نفاعلات الاستبدال الإلكتروفيلية على البيريدين.
تفاعلات الاستبدال المحبّة للنواة (النكليوفيلية)عدل
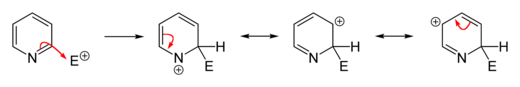
يسهل حدوث مثل هذه التفاعلات على حلقة البيريدين على العكس من البنزين، ويعود ذلك إلى انخفاض الكثافة الإلكترونية بسبب وجود ذرّة النتروجين. تتضمّن هذه التفاعلات حدوث استبدال مع حذف أيون هيدريد مع تشكّلمركّبات وسطية لها تشكيل الأراين، وغالباً ما تتمّ على الموقعين 2 و 4.[66][67]
تحدث تفاعلات الاستبدال المحبّة للنوى بشكل أسهل مع مشتقّات البيريدين ذات المجموعات المغادرة مثل البروم أو الكلور أو الفلور أو حمض السلفونيك. تتضمّن الكواشف المحبّة للنواة (النكليوفيلة) كلّاً من الألكوكسيد والثيولاتوالأمينات والأمونياك.[83] على العموم، فإنّ أيون الهيدريد مجموعة مغادرة ضعيفة، ولا يغادر إلّا في بعض التفاعلات الحلقية غير المتجانسة، وتلك تتضمّن تفاعل تشيشيبابين، والذي يعطي مشتقات البيريدين الأمينية على الموقع 22. ولذلك الغرض يستخدم أميد الصوديوم كاشفاً محبّاً للنواة للحصول على 22-أمينو البيريدين. يتحرّر أيون الهيدريد في هذا التفاعل ويتّحدّ مع بروتون من مجموعة أمين متوفّرة في الوسط ليشكّل جزيء هيدروجين.[67][84]
التفاعلات الجذريةعدل
إضافة عدد من أحمض لويس إلى البيريدين.
يخضع البيريدين إلى تفاعلات جذرية، والتي تكون مسؤولة مثلاً عن حدوث ديمرة في وجود حفّاز من الصوديوم الفلزّي أو نيكل راني إلى 4،4'-بيبيريدين،[85] أو 2،2'-بيبيريدين؛[86] وهي مركبات طليعية مهمّة في الصناعة الكيميائية. من التفاعلات الجذرية الأخرى للبيريدين تفاعل مينيتشي، والذي يعطي 2-رابعي بوتيل البيريدين من تفاعل البيريدين مع حمض البيفاليك ونترات الفضة والأمونياك في حمض الكبريتيك بمردود 97%.[66]
التفاعلات على ذرة النتروجينعدل
تسهل إضافة أحماض لويس إلى ذرّة النتروجين في البيريدين، حيث تتشكّل مركّبات البيريدينيوم الموافقة. إذ يؤدي التفاعل مثلاُ مع هاليدات الألكيل إلى ألكلة ذرّة النتروجين، وهذا يؤدّي إلى تشكّل شحنةٍ موجبةٍ في الحلقة، والتي تزيد من قابلية البيريدين إلى حدوث تفاعلات الأكسدة والاختزال. يستخدم تفاعل زينكه مثلاً من أجل الحصول على مركّبات البيريدينيوم وفق آلية جذرية.
اختزال البيريدين إلى البيبريدين
الأكسدة والاختزالعدل
يمكن اختزال البيريدين إلى البيبريدين، وهو الشكل المختزَل المهدرَج من البيريدين، باستخدام غاز الهيدروجين بوجود حفّاز نيكل راني.[87] يعدّ هذا التفاعل ناشراً للحرارة، ويحرّر طاقة مقدارها 193.8 كيلوجول/مول،[88] وهي أقلّ بقليلٍ من الطاقة المنتشرة عن هدرجة البنزين ((205.3 كيلوجول/مول).[88]
يستحصل على مشتقّات البيريدين المهدرجة جزئياً تحت شروط معتدلة. على سبيل المثال، يعطي الاختزال باستخدام هيدريد ألومنيوم الليثيوم مزيجاً من 4،1-ثنائي هيدرو البيريدين و 2،1-ثنائي هيدرو البيريدين و 5،2-ثنائي هيدرو البيريدين.[89] يمكن الحصول على 4،1-ثنائي هيدرو البيريدين بشكل انتقائي باستخدام معقّدات عضوية فلزّيةمن المغنسيوم والزنك.[90] أمّا (4،3Δ)-رباعي هيدرو البيريدين فيحصل عليه من الاختزال الكهركيميائي للبيريدين.[91]
الاستخداماتعدل
استخدام البيريدين في الصناعات الكيميائية؛ والصورة تبرز عامل في معمل في برلين سنة 1959 بالقرب من حاوية لهذا المركّب.
يمثّل البيريدين أحد المواد المهمّة في الصناعات الكيميائية حيث يستخدم في العديد منها مثل الصناعات الدوائية، وصناعة المبيدات، وصناعة المطّاط واللواصق؛ كما يستخدم في الاصطناع العضوي كمحلّ (مذيب) وكمادّة متفاعلة.[92]بلغ الإنتاج العالمي من هذه المادّة سنة 1989 حوالي 26 ألف طنّ؛[17] ثم لا لبث أن ازداد بشكل مطّرد منذ أوائل الألفية الثانية، بحيث أنّ سعة الإنتاج السنوي بلغت 300 ألف طن في الصين لوحدها.[93]
يستخدم البيريدين في تحضير المبيدات بشكل رئيسي كمادّة أوّليّة طليعيّة لإنتاج مبيدات الأعشاب باراكواتوديكوات.[17] كما أنّ الخطوة الأولى في تحضير المبيد الحشري كلوربيريفوس تنطلق من كلورة البيريدين؛ وكذلك الأمر في تحضير مبيد الفطريات بيريثيون.[14] وفق تفاعل زينكه يدخل البيريدين في تحضير كلوريد سيتيل البيريدينيوم و كلوريد لوريل البيريدينيوم، واللّذان يستخدمان من ضمن المعقّمات في مستحضرات العناية بالفم والأسنان.[53]
اصطناع باراكوات[94]
يصنّف البيريدين من ضمن المذيبات العضوية القطبية القاعدية ذات التفاعلية الضعيفة، ويستخدم لذلك الغرض في عدد من التفاعلات الكيميائية مثل تكاثف كنوفيناغل.[14] يعدّ البيريدين ملائماً كمذيب بشكل خاص في تفاعلات نزع الهالوجين، حيث يتصرّف كقاعدة فيتفاعلات الحذف ويرتبط مع هاليد الهيدروجين الناتج ليشكل ملح بيريدينيوم الموافق؛ وكذلك الأمر في تفاعلات التكاثف.[95]
تفاعل حذف بوجود البيريدين
كقاعدة يستخدم البيريدين أحياناً في معايرة كارل-فيشر، ولكنّه غالباً ما يستخدم الإيميدازول عوضاً عنه، لأنّ الأخير ألطف رائحةً.[96] يستخدم البيريدين من ضمن المذيبات في صناعة الأصبغة والمطّاط؛[97] وكذلك الأمر في صناعة النسيج لتحسين سعة التشبيك في القطن.[53] في استعمال آخر يضاف البيريدين إلى الإيثانول لتغيير مذاقه وجعله غير ملائماً للشرب؛[53] وتقع قيمة عتبة الكشف عن البيريدين في المحاليل بين 1 - 33 ميلي مول/اللتر (بين 79–237 مغ/ل).[98]
أكسدة كحول إلى ألدهيد باستخدام كاشف كولنز.
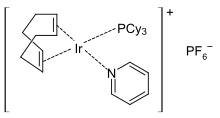
بنية حفّاز كرابتري.
يستخدم البيريدين كمادّة أوّليّة طليعية في تحضير عدد من المركّبات ذات الأهمية في الصناعة؛ فتؤدّي هدرجته مثلاً إلى الحصول على بيبريدين، وهو وحدة بناء اصطناعية مهمة. تتمّ عملية الهدرجة باستخدام حفّازات من النيكل أوالكوبالت أو الروثينيوم عند درجات حرارة مرتفعة.[99] كما يستخدم في تحضير 4-ثنائي ميثيل أمينو البيريدينيوم(DMAPP)، والذي يعدّ من المذيبات الفعّالة.
انطلاقاً من البيريدين طوّر إلياس جيمس خوري مع وليام ساغز سنة 1975 مركّب كلوروكرومات البيريدينيوم، والذي يستخدم في أكسدة الكحولات الأوّلية والثانوية إلىالألدهيدات والكيتونات على الترتيب.[100] يحصل على المركّب من إضافة البيريدين إلى محلول من حمض الكروميك وحمض الهيدروكلوريك المركّز:
{\displaystyle \mathrm {C_{5}H_{5}N+HCl+CrO_{3}\longrightarrow [C_{5}H_{5}NH][CrO_{3}Cl]} }
يعدّ كاشف كورنفورث (ثنائي كرومات البيريدينيوم)،[101]وكاشف كولنز (مزيج معقّد من ثلاثي أكسيد الكروم مع البيريدين في ثنائي كلورو الميثان)، [102][103] من ضمن الكواشف المستحصلة من البيريدين ومركّبات الكروم، والتي تستخدم بشكل أساسي في الأكسدة، إلّا أنّ استخدامها انخفض بشكل كبير بعد حقبة سبعينات وثمانينات القرن العشرين لأنّها سامّة ومسرطنة.[104]
يستخدم البيريدين بشكل واسع من ضمن الربيطات في كيمياء المعقدات التناسقية، وكذلك الأمر مع ثنائي البيريدين(بيبيريدين) وثلاثي البيريدين (تيربيريدين). عندما تكون ربيطة البيريدين جزءاً من المعقّد التناسقي، فإنه يسهل استبدالها بقاعدة لويس قوية. تستخدم هذه الخاصّة في تحفيز عملية البلمرة،[105][106] وفي تفاعلات الهدرجةباستخدام حفاز كرابتري على سبيل المثال.[107]
المخاطرعدل
للبيريدين نقطة وميض تبلغ 17 °س، بالتالي له قابلية للاشتعال مرتفعة؛ وتبلغ درجة الاشتعال 5500 °س، كما أن مزيج نسبته 1.7–100 % حجماً مع الهواء هو مزيج انفجاري. يبدأ التفكّك الحراري عند 490 °س، حيث ينتجالبيبيريدين (بشكل أساسي 2،2'-بيبيريدين، وبشكل أقل3،2'-بيبيريدين و 4،2'-بيبيريدين) وكذلك أكاسيد النتروجين وأحادي أكسيد الكربون.[57] ينحلّ البيريدين بسهولة في الماء، وله تأثير سلبي ومضرّ على الحيوانات والنباتات في الأوساط المائية.[108] تبلغ قيمة حد العتبةللبيريدين 15-30 جزء في المليون (ppmm) في أغلب البلدان منذ تسعينات القرن العشرين؛[14] والتي انخفضت إلى 5 ppm في العقد الأول من الألفية الثانية.[109]
استقلاب البيريدين
البيريدين ضارّ ومؤذٍ لجسم الإنسان في حال الاستنشاق والتناول والامتصاص عن طريق الجلد.[110] من آثار التسمّم بالبيريدين حدوث الأعراض التالية: الدوار والصداع والترنّح والغثيان ونقص الشهية؛ كما يمكّن أن تتطوّر الأمور إلى ألم معوي، ووذمة الرئة وإغماء.[111] سُجّلت حادثة وفاة أحدهم بعد تجرّعه نصف كأس من البيريدين.[14] إنّ أقلّ جرعة مميتة للإنسان معروفة للبيريدين هي 5000 مغ لكل كيلوغرام. عند الجرعات المرتفعة يكون للبيريدين تأثير مخدّر، وعندما تكون تراكيز الأبخرة فوق 3600 جزء في المليون ppm فإنّ ذلك يمثّل خطراً على الصحّة.[17] يمكن أن يكون للبيريدين آثار سلبية ثانوية من حيث السمّية العصبية والجينية.[14][57][112] وفق دراسة أجريت بين سنتي 1981 و 1983 من المعهد الوطني الأمريكي للسلامة والصحة المهنية فإن عدد الأفراد الذين كانوا على تماس مباشر مع البيريدين في عملهم كان حوالي 433 ألف أمريكي.[113]
لا توجد أدلّة كافية تشير إلى كون البيريدين مسرطناً للإنسان؛ على الرغم من أن بعض الدراسات أشارت إلى إمكانية وجود آثار مسرطنة للبيريدين على الحيوانات.[111] تشير البيانات المتوفّرة أن احتواء مياه الشرب على البيريدين أدّت إلى تخفيض قابلية الحركة للنطاف عند الفئران في كافّة مستويات التعرّض للجرعات؛ كما زادت مدّة الدورة النزوية عند أعلى مستوى جرعة عند الجرذان.[111]إنّ الناتج الرئيسي لاستقلاب البيريدين هو N-ميثيل هيدروكسيد البيريدينيوم؛[57][112] وذلك بواسطة الإنزيم الناقل لمجموعة الميثيل على ذرّة النتروجين N-methyltransferase. من نواتج الاستقلاب أيضاً كل منN-أكسيد البيريدين ومركّبات هيدروكسي البيريدين المختلفة، والتي يحصل عليها بواسطة إنزيم مونوأكسجيناز. يتحلّل البيريدين بفعل البكتريا إلى الأمونياك وثنائي أكسيد الكربون؛[114] وفي تلك العملية تتحلّل حلقة البيريدين بشكل أسرع بالمقارنة مع البيكولين واللوتيدين و2-كلورو البيريدين وأمينو البيريدين؛[115] كما وجد أنّ عدداً من محلّلات البيريدين أظهرت تراكيز مرتفعة من ريبوفلافين.[116]
تحدث تأثيرات متبادلة (تآثرات) بين المركّبات الحلقية غير المتجانسة الحاوية على النتروجين متضمّنةً البيريدين مع التربة، عن طريق آليات متعدّدة معتمدة على pH الوسط، بما فيها حدوث تجزئة في المواد العضوية الترابية والتبادل الأيوني وحدوث تفاعلات تعقيد على السطح.[117] إن حدوث امتزاز على السطوح في الحالات المذكورة يقلّل منالتوافر الحيوي لمركّبات البيريدين للمحلّلات المكروبية والكائنات الحية الأخرى، وبالتالي يقلّل من معدّلات التحلّل ويزيد من السمّية البيئية.[118] تتحرّر كمّيّات قليلة من البيريدين إلى الوسط المحيط البيئي من العمليات الصناعية مثل صناعة الفولاذ،[119]
بالإضافة إلى الصخر الزيتيوتغويز الفحم والتكويك وترميد النفايات.[14] يمكن أن يصل تركيز البيريدين في الغلاف الجوي عند منشآت الصخر الزيتي إلى 13 ميكروغرام/م3؛[120] كما أنّ تراكيز البيريدين في المياه الجوفية بالقرب من محطّات تغويز الفحم وصلت إلى 53 ميكروغرام/م3.[121]
المصدر ويكيبيديا الموسوعة الحرة
المصادر
- Joule، J. A.؛ Mills، K. (2010). Heterocyclic Chemistry (الطبعة الخامسة). Chichester: Blackwell Publishing. ISBN 1-4051-3300-7.
- Lide، D. R., المحرر (2009). Handbook of Chemistry and Physics (الطبعة التسعون). Boca Raton: CRC Press. ISBN 978-1-4200-9084-0.


















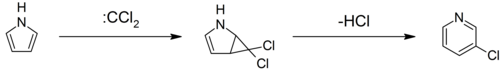



















 رد مع اقتباس
رد مع اقتباس