تشكل ظاهرة اغناء المياه, وتعرف ايضا باسم التأجين (Eutrophication), والتي تعني زيادة المواد الغذائية في المياه, واحدة من المشاكل البيئية التي تعاني منها البحيرات والتجمعات المائية. حيث ان هذه الظاهرة غالبا ما تؤدي الى تدهور جودة المياه وتتسبب في نقص الاكسجين والعناصر الضرورية لنمو الكائنات الحية وتكاثرها مما يؤدي الى انخفاض حاد في عدد الاسماك وموت النباتات المائية. وتعد المركبات التي تحتوي على الفوسفور من اهم مصادر انتشار ظاهرة اغناء المياه.
بسبب استخدام المواد التي تحتوي على الفوسفور, مثل مواد التنظيف, فان مياه الصرف البلدية غالبا ما تحتوي على كميات من الفوسفور اكبر من تلك التي يمكن معالجتها بالطرق البيولوجية. لذلك تلجأ محطات معالجة المياه الى التقنيات الكيميائية للتخلص من الفوسفور, اذ يمكن حل ايونات الفوسفات المذابة عن طريق التفاعل مع ايونات الالمنيوم او الحديد او الكالسيوم. ويشكل الالمنيوم والحديد ايونات ثلاثية التكافؤ, بيما يشكل الكالسيوم ايونات ثنائية التكافؤ, لذلك تختلف التفاعلات قليلا.
وبعد الانتهاء من اداء مهمتها بالتخلص من الفوسفور يمكن عزل الاملاح المتشكلة بكل سهولة من مياه الصرف المعالجة. والتفاعل الاكثر بساطة مع عنصر ثلاثي التكافؤ يمكن ان يكون بالشكل التالي:
والواقع ان كلا من التفاعلين تؤدي الى انخفاض في القلوية وبالتالي في درجة الحموضة (pH). ومن خلال التفاعل الثاني يمكن ان تتشكل عناصر هيدروكسيد (Hydroxide) على شكل بقع تمتص الجزئيات الصغيرة جدا كالجزئيات الغروية. لذلك فان اسلوب المعالجة هذا يمكن الاستفادة منه للتخلص من مواد اخرى غير الفوسفور.
ايون الالمنيون ثلاثي التكافؤ هو الايون الاكثر فعالية لترسيب الفوسفور من مياه الصرف الصحي. نظريا يتطلب واحد مول من الالمنيوم لترسيب واحد من مول من ايونات الفوسفور. ولكن الالمنيوم لا يتفاعل فقط مع الفوسفور, ولكن ايضا مع المياه ومع المواد القلوية الموجودة في المياه.
ومع استخدام التفاعل مع الكالسيوم ثنائي التكافؤ فان صيغة التفاعل تكون بالشكل التالي:
ويمكن تحقيق ترسب الفوسفور باستخدام الكالسيوم عن طريق اضافة هيدروكسيد الكالسيوم, او ما يُعرف بالجير المطفأ, او باضافة اكسيد الكالسيوم, والذي يُعرف بالجير الحي.
كذلك يمكن الاستفادة من الحديد ثنائي التكافؤ ( والمعروف باسم حيديدوز او فيروز, اما مركب الحديد ثلاثي التكافؤ فانه يُعرف باسم حديديك), وذلك نظرا لتكلفته المنخفضة بالمقارنة مع الحديديك. حيث ينتج عن استخدامه عملية تأكسد من الحديدوز الى الحديديك ومن ثم يتفاعل مع الفوسفور بنفس عملية تفاعل الالمنيوم سالفة الذكر.
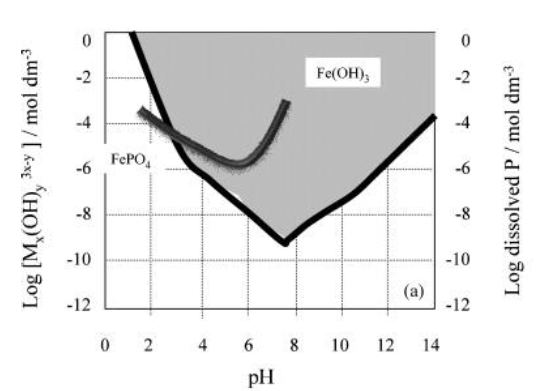
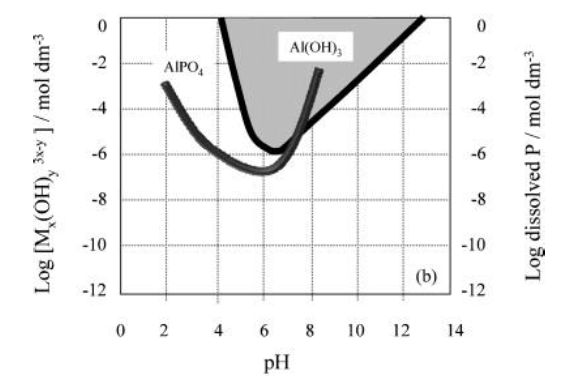
تعتمد قابلية ذوبان الاملاح المختلفة على درجة الحموضة. الشكل التالي يوضح قابلية الذوبان لكل من الالمنيوم والحديد وامكانية تشكيلها للترسب الكيميائي لايونات الفوسفور. واذا ما تمت اضافة اي مادة بما لا يتوافق مع درجة الحموضة, فان تلك المادة تتحلل وتخرج مع المياه دون ان نحصل على فائدة منها.
قابلية ذوبان الحديد بحسب كل درجة حموضة
قابلية ذوبان الالمنيوم بحسب كل درجة حموضة.
وحتى كمية الجرعة (Dose) لها اهميتها. فيمكن ان تؤدي الجرعة العالية من الحديد والالمنيوم الى الخسارة المادية بالاضافة الى عدم الحصول على النتائج المرجوة. وبما انه لكل مياه خصائصها الكيميائية فانه يجب اجراء الاختبارات المطلوبة لكل نوعية مياه قبل اضافة الجرعة اليها. وفي الواقع فانه يتطلب من 1 الى 1.5 مول من الحديد او الالمنيوم لكل مول من الفوسفات.
هذا كل ما اردت قوله عن المعالجة الكيميائية لمياه الصرف الصحي, للاطلاع على الجزء السابق اضغط هنا
ارجو ان اكون قد وُفقت للزيادة في معلوماتكم وتقديم بعض الفائدة لاعزائي من اعضاء وزوار منتديات درر العراق.
تقبلوا تحياتي مع





 المعالجة الكيميائية لمياه الصرف (3) التخلص من الفوسفور
المعالجة الكيميائية لمياه الصرف (3) التخلص من الفوسفور
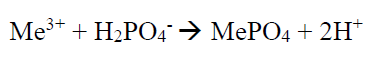
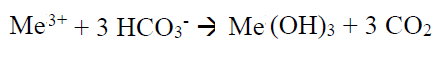
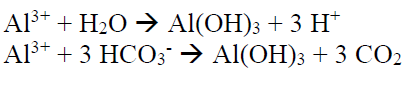
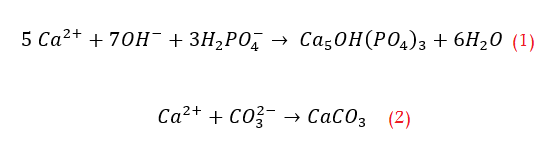

 رد مع اقتباس
رد مع اقتباس