الخصائص الكهربائية
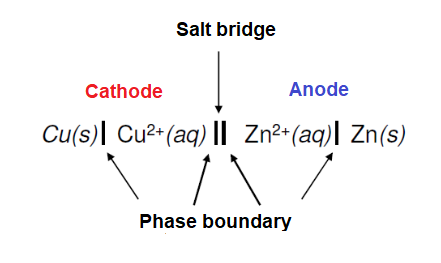
عندما يتم غمر المصعد, القطب السالب, في الكهرل يحدث تفاعل كهروكيميائي, بحيث يكون هناك هناك فائض من الالكترونات. واذا كان المصعد, القطب الموجب, مغمورا في نفس الكهرل فانه يحدث تفاعل كهروكيميائي اخر, ولكن ينتج عنه فقدان للالكترونات. واذا كان كلُ من القطبين متصلين ببعض عن من خلال موصل كهربائي خارجي, مثل المصباح الكهربائي او الهاتف المحمول, فان تيار الالكترونات يتدفق من القطب السالب, حيث يوجد الفائض, الى القطب الموجب, حيث يوجد نقص في الالكترونات. وبطريقة عكسية يتدفق تيار من الايونات كعناصر جديدة حتى يمكن للتفاعل الكهروكيميائي ان يتسمر. الصور التالية توضح العملية :
الجهد الكهربائي (Voltage)
يُعتبر الجهد الكهربائي عبر الخلية احد خواص المادة التي يتم اختيارها لصناعة القطبين السالب والموجب. حيث عادة من يتم تدوين العديد من المواد في قوائم مع مواصفاتها القياسية. فمثلا خلية نيكل- كادميوم ( Nickel- cadmium), والتي تختصر بـ "NiCd" ذات 1.2 فولت. بينما بطاريات ليثيوم- ايون (Lithium-ion)تأتي بخصائص 3.6 فولت.
عندما يتم تحميل الخلية فاننا نحصل على جهد اقل. ولكن عندما يتم شحنها فانه يتم الحصول على جهد اعلى.
وتستخدم مصطلحات مختلفة جهد الخمول, الجهد الاسمي, جهد العمل, الجهد النهائي, جهد الشحن. فمثلا جهد بطارية الرصاص:
نوع الجهد القوة (فولت) جهد الخمول 2.1 الجهد المسمى 2.0 جهد العمل 2.0-1.75 الجهد النهائي 1.75 جهد الشحن 2.5
القدرة
يتم تحديد قدرة الخلية من خلال كمية الطاقة الكهربائية الكلية التي يتم الحصول عليها من عملية التفاعل الكهروكيميائية, بمنعى اخر كمية الالكترونات المتدفقة من القطب السالب الى القطب الموجب, والتي يُعبر عنها بوحدة كولوم (Coulomb), ويُرمز اليها بـ "C" او "As", او بوحدة امبير- ساعة (Amp- hour), والتي يُرمز اليها بـ "Ah".
للاطلاع على الجزء الاول, تفضل بالضغط هنا
نلتقي في الجزء التالي
ملاحظ: الموضوع مترجم من اللغة السويدية حصريا لمنتديات درر العراق. وان حقوق الترجمة محفوظة لمنتديات درر العراق فيجب الاشارة لذلك عند النقل او اي استخدام اخر.





 كيف تعمل البطاريات (2)
كيف تعمل البطاريات (2)

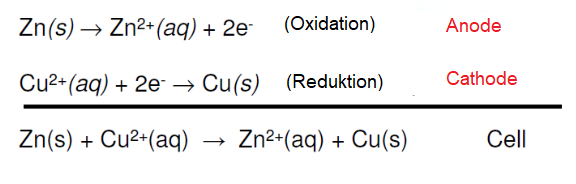

 رد مع اقتباس
رد مع اقتباس