التثخر الكيميائي (Flocculation) عملية مهمة جدا وشائعة لتنقية المياه. فمن خلال التثخر يمكن فصل الملوثات العالقة او الغروية (Colliod); وهي جسيمات صغيرة لا تترسب, الموجودة في مياه الصرف. كما يستخدم التلبد, وهو الاسم الثاني لعملية التثخر, لتنقية مياه اخرى كتلك المخصصة لتكون مياها للشرب.
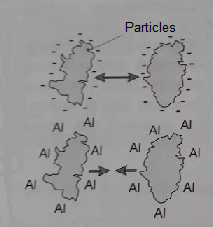
الجسيمات الغروية التي في المياه عادة ما تكون ذات شحنة سطحية سالبة, وهذا يسبب تنافرها من بعضها البعض. اذ انه بسبب قوى التنافر فان تلك الجسيمات لا يمكنها الاقتراب من بعضها البعض على عكس ما تريده قوى فان دير فالس ( Van Deer Wauls Forces)من دمج الجسيمات. ينتج عن ذلك ان تلك الجسيمات لا يمكنها ان تتكتل الى اجسام اكبر وبالتالي لا يمكنها ان تترسب. لذلك فان مياه الصرف التي تحتوي على جسيمات غروية ستبقى عكرة حتى بعد خروجها من محطة المعالجة.
طرق التخلص من الاجسام الغروية
ولكن يمكن زعزعة استقرار الجسيمات الغروية بعدة طرق, منها:
1. التجلط باضافة ايونات ذات شحنات موجبة مثل ( +Fe3) او (+Al3).
2. اضافة ندف بوليمرية مشحونة.
1. التجلط
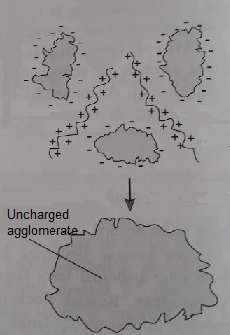
ببساطة يمكن شرح عملية التجلط: اذا اضفنا الاملاح ذات الشحنات الموجبة الى المياه التي تحتوي على جسيمات غروية فان الايونات الموجبة يمكن ان تلامس اسطح تلك الجسيمات بحيث تكون الشحنات على سطح الجسيمات في حالة تعادل, وبذلك تتمكن قوى فان دير فالس من جذب الجسيمات الى بعضها البعض بحيث تصبح كتلة واحدة اكبر حجما.
وللحصول على تحييد فعال لشحنات الجسيمات الغروية مع اقل كمية ممكنة من الاملاح ينبغي اختيار نوع من الاملاح ذي مستوى عالٍ من الشحنات, عادة ما يستخدم كلوريد الحديد الثلاثي ( Iron (III) Chloride), كبريتات الالمنيوم (Aluminum sulfate) او كلوريد الالمنيوم ( Aluminium chloride). ولكن احيانا تستخدم حتى العناصر التي تصل شحناتها الموجبة الى 7.
ولانجاز عملية التجلط لابد ان تكون درجة الحموضة (pH) مناسبة بحيث تكون كمية المواد الكيمائية الغير مستهلكة في في المياه منخفضة جدا.
كذلك ينبغي مزج المواد المسببة للتجلط باسرع وقت ممكن, خلال ثانية واحدة من الوقت. واما عند استغراق وقت اطول فان ايونات المعادن تتفاعل مع المياه وتنتج ما يعرف بالهيدروكسيد (Hydroxide), تكون على شكل بقع صغيرة في المياه. تلك البقع وبحسب درجة الحموضة يمكن ايضا ان تساهم بالتخلص من الغرويات, ولكن مشكلتها انها قد لا تكون فعالة بما يكفي, كما ان التعامل معها صعب ويجب ان يكون بحذر شديد.
2. اضافة بوليمرات
اما الطريقة الثانية لزعزعة الجسيمات الغروية تكون باضافة بوليمرات متماسكة الى المياه. عادة ما يتم استخدام بوليمرات صناعية مثل متعدد التكهرل ( Polyelectrolyte). تمتص الجسيمات الغرويات تلك البلويمرات ليتشكل ما يشبه الجسر بحيث تعبر الجسيمات وتتلاصق مع بعضها البعض لتتشكل كتلا يمكن التخلص عنها بالترسب.
استخدام التثخير الكيميائي
ان عملية التثخير الكيميائي عادة ما تستخدم لمعالجة المياه كتلك التي يراد استخدامها لغرض الشرب بحيث لا يبقى بها اي لون ولا تعكر صفوها تلك الجسيمات الغرويات وتكون خالية من اي نوع من الملوثات.
فبعد المزج السريع للمياه مع مواد التثخير ومن ثم خفض سرعة المزج تدريجيا نحصل على مجموعات من الملوثات التي يراد التخلص منها.
في مياه الصرف البلدية يُستخدم التثخير الكيميائي كتقنية لمعالجة الفوسفور وكذلك للتخلص من المواد العضوية الملوثة للمياه.
اما المياه الصرف الصناعي فانها تحتوي على كمية لا بأس بها من المواد الكيميائية المثخرة, وبالتالي لا نحتاج الى عملية التثخير الا مع بعض المياه الصناعية كتلك القادمة من معامل المعادن, حيث نستخدم الطريقة الثانية سالفة الذكر للتخلص مثلا مركبات مثل هيدروسيد المعادن.
كذلك يُستخدم التثخير الكيميائي لمعالجة مياه صناعة السليولوز, وكذلك معامل النسيج, للتخلص من المواد العالقة مثل بقايا الالياف. وتُستخدم ايضا في معالجة مياه الصناعات الغذائية كونها تحتوي على المواد العضوية, ومياه الصناعات النفطية للتخلص من الزيوت.
من هنا يمكنكم الاطلاع على مقدمة هذه السلسلة
نلتقي في الجزء القادمة





 المعالجة الكيميائية لمياه الصرف (2) التثخر الكيميائي
المعالجة الكيميائية لمياه الصرف (2) التثخر الكيميائي
 رد مع اقتباس
رد مع اقتباس