بسم الله الرحمن الرحيم
يعرف علم الديناميكا الحرارية، او ما يسمى بالثرموديناميك, على انه العلم الذي يدرس خواص الطاقة وتحولها بين اشكال مختلفة. واكثر ما يهتم به هو التفاعل ما بين الحرارة والعمل.
وبمرور الوقت, واثناء مسيرة تطور هذا العلم, استطاع العلماء ان يضعوا اربعة مبادئ او قوانين, والتي تصف جوانب مختلفة من الطاقة وكيفية تحولها بين اشكالها المختلفة. وهذه القوانين هي:
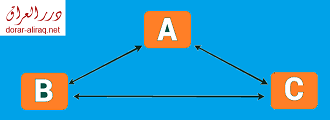
- القانون رقم صفر, والذي يسمى بقانون التوازي الحراي, وينص على انه اذا كانت الطاقة في الجسم A تساوي الطاقة بالجسم B والتي بدورها تساوي طاقة الجسم C, فان الطاقة بالجسم C تساوي ايضا طاقة الجسم A.
- القانون الاول, وهو القانون محل البحث ويعرف باسم مبدأ حفظ الطاقة. ينص القانون الاول على ان الطاقة لا تستحدث ولا تفنى, وانما تتحول من صيغة الى اخرى. سنأتي لهذا القانون بتفصيل اكثر لاحقا بعد استعراض سائر القوانين.
-القانون الثاني وهو قانون الانتروبيا وينص على ان الانتروبيا في النظام المغلق لا يمكن ان تنقص, وانما تزداد في حال حدث تغيير في الخواص الفيزيائية للنظام او تبقى على حالها. وعلى هذا الاساس فان الحرارة تنتقل من الجسم الحار الى الجسم البارد, وليس العكس.
- القانون الثالث: وينص على انه لا يمكن ان نصل الى درجة حرارة الصفر المطلق, والتي تساوي صفر بمقياس كلفن. وللمعلومات اكثر حول هذا القانون يمكن مراجعة موضوع الاخ رجل كهل:
الصفر المطلق ( البرودة المستحيلة )
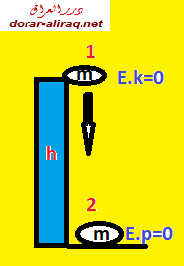
نحن نعلم ان اي شئ في الكون لابد وان يحتوي على مقدار من الطاقة, تسمى بالطاقة الكامنة. وهذه الطاقة يمكن تحويلها الى طاقة حركية. فاذا سقط جسم ما من ارتفاع معين فان طاقته الكامنة ستنخفض تدريجيا في نفس الوقت التي تزاد فيه طاقته الحركية. طبعا هذا بغض النظر عن العوامل الاخرى التي يمكن ان تؤثر في عملية التحول هذه, مثل مقاومة الهواء. الصورة التالية توضح هذا المفهوم:
وهذا يؤكد على مبدأ الطاقة الميكانيكية.
لنفترض ان منظومة ما تخضع لعدة عمليات لا تبدالية, بمعنى انه لا يوجد اي تبادل حراري بين المنظومة ومحيطها. واذا كانت هذه العمليات لا تحتوي على اي نوع من انواع النقل الحراري فانها قطعا تنطوي على انواع عدة من التفاعلات. وتشير التجارب الى ان صافي العمل المنجز هو نفسه في جميع العمليات اللا تبدالية والتي تكون بين مرحلتين محددتين في الانظمة المغلقة. هذا بغض النظر عن طبيعة النظام المغلق وتفاصيل العملية.
وبالنظر الى انه هناك عددا لا حصر له من الطرق لاجراءات التفاعلات في ظل ظروف العمليات اللا تبادلية, فان هذا البيان يبدو قويا جدا, مع احتمال امكانية حدوث اثار بعيدة المدى.
من نتائج القانون الاول للديناميكا الحرارية هو انه صار بمقدورنا التعرف على خصائص الطاقة الاجمالية. فبالنظر الى ان صافي العمل المنجز هو نفسه في كل العمليات اللا تبدالية في المنظومة المغلقة, والتي تكون بين نقطتين محددتين, فانه يجب ان تعتمد قيمة العمل الصافي على الحالات النهائية للمنظومة فقط. وبالتالي يجب ان تتوافق مع مع التغيير في خواص النظام, وهذه هي خطائص الطاقة الاجمالية.
وهنا يجب الاشارة الى ان القانون الاول للديناميكا الحرارية لا يهتم بقيمة الطاقة الاجمالية ضمن حالة واحدة في النظام المغلق. لانه ببساطة ينص على ان التغيير في اجمالي الطاقة خلال العملية اللاتبادلية يجب ان تتساوى مع صافي العمل المنجز. لذلك يمكن اختيار اي قيمة عشوائية ضمن اجمالي الطاقة في حالة محددة لتكون بمثابة نقطة مرجعية.
لتوضيح ما سبق نضرب بعض الامثلة:
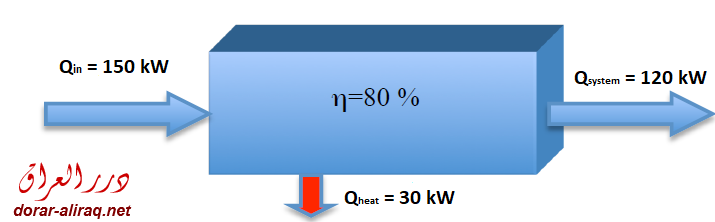
اذا كان هناك نظام يعمل بكفائة 80 % فانه من الجهد المبذول لتشغيله, اذا افترضنا 150 كيلو واط, يستخدم فقط 120 كيلو واط ويتحول الباقي الى طاقة حرارية, كما في الصورة
في حين انه لو كان ذلك النظام نظاما معزولا لا تبادليا, اي ان كفائته 100 %, فان الطاقة الاجمالية التي يستهلكها هي نفسها الجهد المبذول لتشغيله. ففي المثال السابق فان النظام لا يستقبل الا 120 كيلوواط من الجهد, وهي نفسها الطاقة التي يحتاجها للعمل.
ملاحظة: للمزيد من المعلومات حول مختلف الانظمة يمكنكم مراجعة موضوعي التالي:
النظام والفرق بين حجم الدراسة وكتلة الدراسة





 رد مع اقتباس
رد مع اقتباس
 اشكرك لنقلك لنا هنا
اشكرك لنقلك لنا هنا 