سنحاول في هذا المقال أن نلقي الضوء على فرع رائع وممتع من الكيمياء وهو كيمياء الكم! دائما ما نسمع عن فيزياء الكم ولكن الكثيرين لم يسمعوا من قبل بهذا الفرع من الكيمياء مطلقاً. فما هي كيمياء الكم؟
كيمياء الكم هي التخصص القائم على استخدام قوانين وقواعد ميكانيكا الكم في الكيمياء لتفسير ظواهر دون ذرية على مستوى الالكترونات خاصة. كيف تتكون الروابط الكيميائية؟ وكيف تتحرك الالكترونات حول النواة؟ وما هي أشكال الأوربيتالات الذرية؟ ببساطة هى الفرع من الكيمياء الذى يمكن استخدامه لتفسير ظواهر كيميائية معينة عن طريق ميكانيكا الكم.
ونلاحظ هنا ان الروابط التي تتكون بين الذرات لتكون الجزيئات هي جسيمات دون ذرية، اي تنطبق عليها فعلا قوانين ميكانيكا الكم ويمكن فعلاً استخدام فيزياء الكم لتفسير ظواهر كيميائية.
قبل انا نبدأ الحديث ننبه على ان اهتمامنا فى كيمياء الكم بنوع معين من الجسيمات وهو الالكترون خاصة لانه هو السبب فى تكون الروابط الكيميائية بين الذرات لتكوين الجزيئات.
تعتبر معادلة شرودنجر من أهم أسس ميكانيكا الكم التي وضعها عالم الرياضيات العبقري شرودنجر. الميزة التى اضافتها لنا معادلات شرودنجر هي انها تعطينا نتائج رياضية لما يحدث على المستوى دون الذري مع العلم ان النتائج الرياضية فى كثيرا من الأحيان لا يمكن تخيلها فى عالمنا المعروف، وأيضاً لا يمكن لنا ان نرى تلك الجسيمات وهى تتحرك أبداً فهذا مستحيل. اذن معادلات شرودنجر هي سلاح ذو حدين، فمن ناحية هي تعطينا بيانات عن ما الذي يحدث فى عالم الجسيمات دون الذرية، خصوصاً الالكترونات المسؤولة عن تكوين الروابط الكيميائية بين الذرات، ويمكنها أيضا توقع نتائج صحيحة لسلوك الجسيمات دون الذرية وهذا يمكننا من الاستفادة منها بدرجة كبيرة فى علم الكيمياء.
حسنا نريد ان نعرف كيف تتحرك الإلكترونات حول نواة الذرة؟ ولماذا تظل الإلكترونات فى حالة دوران مستمر حول النواة وفي نفس الوقت فهي لا تنجذب للنواة مع العلم ان النواة تحمل شحنة موجبة، أما الالكترونات فهي سالبة الشحنة؟ وعندما ترتبط الذرات لتكوين الجزيئات من خلال تبادل أو حتى مشاركة الالكترونات فكيف تكون المشاركة فعليا؟ او حتى التبادل وهل هو مشاركة بالمفهوم الكلاسيكي؟ ام ان له مفهوم آخر؟
تتناول كيمياء الكم أموراً كهذه، وتعتبر من فروع الكيمياء التى يتم تدريسها للطلاب المتخصصين بشكل في مجال الكيمياء .
تترتب العناصر الكيميائية في الجدول الدوري بحيث في كل عنصر يزيد الكترون واحد عن العنصر الذي يسبقه، مثال ذلك الهيدروجين الذي يحتوي على إلكترون واحد و الهيليوم على إلكترونين، وهكذا حتى أثقل العناصر في الجدول الدوري.
الملاحظ هنا أنه عند زيادة عدد الإلكترونات، فإن حجم الذرة يزداد تدريجياً من العناصر الأخف إلى العناصر الأثقل تدريجياً، ولكن عندما تزداد تلك الالكترونات فكيف ستدور وأين؟ وهل لها مدارات ومسارات محددة؟ وهل تلك المسارات كمومية بحيث تكون لها مدارات ذات طاقات محددة؟ هنا يأتي دور كيمياء الكم.
ما هي الأوربيتالات الذرية؟
الأوربيتالات الذرية هي ببساطة احتمالية وجود الالكترونات فى اماكن معينة بشكل كبير. فهمنا مسبقاً أن عدد الالكترونات يزداد من العناصر الأخف للأثقل ,اذاً فأين تذهب هذه الإلكترونات او كيف واين تدور؟
تتوزع الالكترونات فى مستويات طاقة محددة حول النواة وهناك أربعة أعداد للكم تتعلق بتلك المستويات، وهي عدد الكم الرئيسي، عدد الكم المداري، عدد الكم المغناطيسي، وعدد الكم المغزلي، وكلٌ من هذه الأعداد يعبر عن تكميم للطاقة فى مجال معين، فعدد الكم الرئيسى يعبر عن المدارات الرئيسية او الاساسية للطاقة حول النواة وهي مكممة؛ أما عدد الكم المداري، فهو يعبر عن تكميم الطاقة في مدار حركة الإلكترونات في داخل الأوربيتالات وهكذا. وما يهمنا هو عدد الكم المدارى لأنه الخاص بتكميم الطاقة فى مجال الاوربيتالات او احتمالية تواجد الإلكترونات فى مدارات محددة حول النواة كما ذكرنا مسبقا.
ولكن المشكلة تكمن فى أنه لا يمكننا أبداً قياس مكان الإلكترون أو طاقته فى نفس اللحظة طبقا لمبدأ عدم التأكد لهايزنبرج. لذا قام شرودنجر بوضع فكرة عبقرية وهي تحديد اكثر الاماكن التي يحتمل تواجد الإلكترونات حول النواة فيها، وهي تسمى الاوربيتالات وهي أيضا تعتبر مستويات طاقة فكل اوربيتال له طاقة محددة. يمكن تحديد شكل الاوربيتالات او طاقتها من حلول معادلات شرودنجر.
فى الحقيقة يصعب التطرق لشرح المعادلة من ناحية الرياضيات لما فيها من تعقيدات رياضية لذا سأحاول التكلم عن المعنى الفيزيائي بشكل أكثر تفصيلاً.
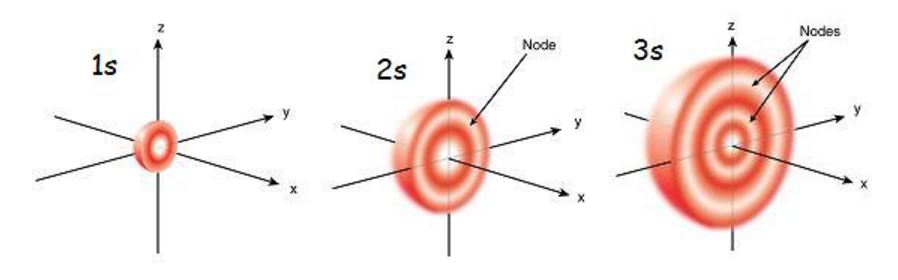
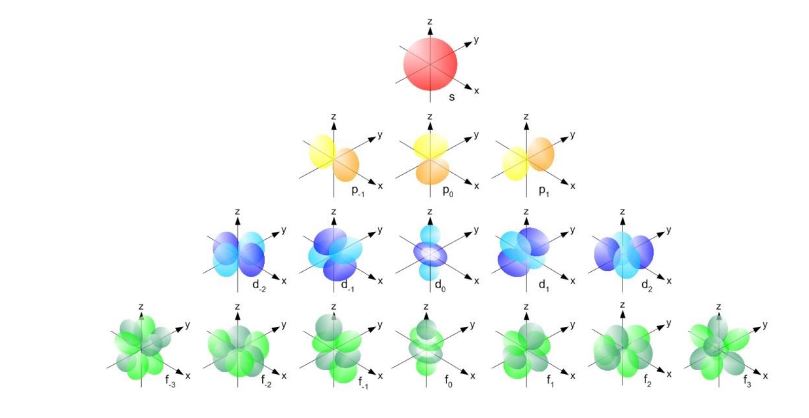
هناك اربعة اوربيتالات (S,P,D,F) وتقابلهم الأرقام (0,1,2,3) وتلك الأرقام هي مجرد ارقام للإشارة للأوربيتال (0=s ) وهكذا.
لنأخذ فكرة بسيطة عنهم، نذكر للمرة الثانية الاوربيتالات هي ليست شيئاً مادياً مثلا، فهي مجرد احتمالية لتواجد الالكترونات أثناء دورانها فى مدارات مكممة حول النواة.
طبعا تتذكرون شلون المدرسين كانوا يحفظوها النا ( اس اس بس بس دبس دبس فدبس )
الاوربيتال S هو أوربيتال كروى الشكل ويشير الرقم قبل (S) عن عدد الكم الرئيسي (n) حيث انه تكميم مزدوج للطاقة بمعنى أن الاوربيتال يقع فى مستوى الطاقة الرئيسى الاول و عدد الكم المدارى الاول هو 0 (او صفر) ال S هنا يسمح لنا ان نحدد طاقة الإلكترونات فى المدارات هذه، وليس ذلك فحسب بل أيضاً احتمالية تواجدها وهي احتمالية تواجد بشكل كروي كما فى الشكل اي ان احتمال تواجد الإلكترونات فى شكل كروي أثناء دورانها حول النواة في هذا الاوربيتال وأيضاً أقصى عدد يتحمله هذا الأوربيتال هو 2 الكترون فقط.
واخيرا نود ان نضيف ان تلك الاشكال و ايضا طاقات تلك المدارات كلها تم تحديدها نتيجة لحلول معادلات رياضية لها معانى فيزيائية وهى معادلات شرودنجر
الاوربيتالات الكروية
اشكال معقدة للاوربيتالات





 كيمياء الكم
كيمياء الكم


 رد مع اقتباس
رد مع اقتباس