تجربة دافيسون وجيرمر
حقيقة نعرفها الآن تماما، وهي أن الجسيمات المادية تملك خواص موجية. هذه الحقيقة معروفة في وقتنا الراهن كما يعرف الجميع أن أرضنا الطيبة تدور حول الشمس وليس العكس..
ومع ذلك، يجب أن نتذكر أن الطبيعة الموجية للجسيمات المادية مثل الإليكترون كانت في وقت ما شيئا يدعو للدهشة والعجب. ويرجع السبب إلى ذلك ببساطة إلى أن الفيزيائيين كانوا قد اعتادوا على التفكير في الإليكترون كجسيم كلاسيكي، كما تتحدث أنت عن كرة تنس أو بيسبول.
حتى كل التجارب التي أجريت قبل عام 1927 كانت تدل على مثل هذا النمط من التفكير، لقد تم اكتشاف الخواص الموجية أولا بالنسبة للفوتونات، ثم تم اكتشاف خواصها الجسيمية لها فيما بعد. أما بالنسبة للإلكترون فقد انعكس هذا الترتيب. وبسبب التتابع التاريخي للأحداث، يميل عامة الناس إلى الاعتقاد بأن الضوء مكون من موجات، وبان الاليكترونات عبارة عن جسيمات.
هذه الصورة غير كاملة وبلا شك، وقد أصبح معروفا بشكل أكثر انتشارا بأن الفوتونات، والإليكترونات، وفي الواقع كل الجسيمات، متشابهة جدا: بمعنى أن لها جميعا بعض الخواص الجسيمية وبعض الخواص الموجية.
مقدمة
كانت البداية فكرة جرئيه طرحها الأمير الفرنسي دي برولي ( وقصة ميله إلى الفيزياء غريبة نوعا ما).
وتتلخص فيما يلي:
إذا كان الفوتون، ذو الطبيعة الموجية، يملك خواصا جسيمية، فما الذي يمنع أن تملك الجسميات المادية الأخرى، خواصا موجية؟؟
ونحن هنا نبدي مزيدا من الاحترام للشجاعة العلمية التي أبداها دي برولي بفرضه الجرئ هذا، والذي لم يدعمه بأي إثبات علمي عملي!
في البداية سنبدأ بمناقشة بسيطة لفرض دي برولي:
نعرف العلاقة بين الطاقة والزخم الخطي للفوتون، الذي يملك rest energy تساوي صفرا، وهي p=E/c ، ونعرف أيضا أن طاقة الفوتون يمكن إيجادها بالعلاقة E=hf ، ولهذا يمكننا أيضا التعبير عن زخم الفوتون كما يلي:
P=E/c =hc/c λ =h/ λ
من هذه المعادلة، نرى أن الطول الموجي، وهو خاصية للموجات، يمكن التعبير عنه بالزخم الخطي، وهو خاصية للجسيمات.
اقترح دي برولي أن الجسيمات المادية يمكن الحديث عنها بنفس الطريقة، فلو تحدثنا عن جسيم له كتلة m وزخم mv ، فإن طول الموجة المصاحبة للجسيم المادي هذا هي:
λ =h/p = h/mv
حيث λ = الطول الموجي،
h = ثابت بلانك،
m = الكتلة،
v = السرعة،
E = الطاقة.
ولو كان ما يفترضه ديبرولي صحيحا، فإنه تحت شروط مخبرية ملائمة، يجب أن تتصرف الإليكترونات، وهي جسيمات، كما تتصرف الموجات، بمعنى أنها ستعاني من حيود وتداخل..
أول من نبه لهذه الفكرة البسيطة هو العالم إلساسر Elsasse عام 1925، عندما قال الفكرة السابقة، وهي انه لو عانت الإليكترونات من حيود وتداخل فإن هذا أكبر دليل على صحة فرض دي برولي وهو أن الجسيمات المادية تملك خواصا موجية.
بناء على هذه الأفكار أجريت تجارب في أول الأمر بواسطة س.ج. دافيسون (C.J.Davisson ) بالاشتراك مع ل. هـ. جيرمر (L.H.Germer ) ، ومستقلا عنهما ج. ب. طومسون (G.P.Thomson ) ...
دافيسون: حصل على جائزة نوبل في الفيزياء عام 1937 مع طومسون جورج باجت لإكتشافهما ظاهرة حيود الإليكترونات
إلساسر: أول من نبه إلى أن إثبات فرضية دي برولي هو الكشف عن حيود الإليكترونات في عام 1925.
في التجربة التي أجراها دافيسون جيرمر تمت دراسة انعكاس الإلكترونات من سطح البلورة، في حين تمت دراسة نفاذ الإليكترون خلال شريحة بلورية رقيقة في تجربة طومسون.
بدأ العمل في تجربة دافيسون - جيرمر في اليوم التالي لوصول أطروحة دي برولي إلى أمريكا.والقصة الحقيقية تحوي الكثير من الحظ وقليل من الفطنة. دعونا معا نتابع القصة:
كانت تجربة دافيسون في الأساس لدراسة طاقة الإليكترونات المتشتتة عن سطح معدن ما (النيكل)، حيث يتم قذف بلورة المعدن بإلكترونات مسرّعة وقياس طاقة وزاوية تشتت هذه الاليكترونات بعد اصطدامها بالبلورة.
وعلى هذا، فتجربة نيويورك لم تكن في بدايتها اختبارا للنظرية الموجية للجسيمات المادية، ولكنها بدأت تأخذ هذا الاتجاه فقط في صيف عام 1926 بعدما نوقشت النتائج التي حصل عليها دافيسون في انجلترا مع مجموعة من علماء الفيزياء الإنجليز.
لنتبع معا بخطوات وئيدة ونشرح الخطوط الرئيسية لتجربة دافيسون، ولنرى الحظ، والصدفة، اللذين بدآ أول خطوة عملاقة نحو ميكانيكا الكم:
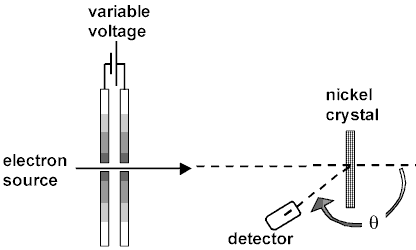
1. وضعت عينة من بلورة النيكل في جهاز مفرغ من الهواء (وهنا سؤال بسيط لكم: لماذا توضع العينة عند قذفها بالإليكترونات في جهاز مفرغ من الهواء، بينما لو أردنا قذفها بأشعة سينية مثلا، بالإمكان وضعها في الهواء الطلق؟)، وكانت العينة موضوعة على قاعدة قابلة للدوران.
2. تنتج حزمة الإليكترونات – في التجربة – من مدفع اليكترونات، حيث يتم تعجيل الإليكترونات إلى الطاقة المرغوبة في حدود 50 فولت.
3. كاشف الإليكترونات، أو ما يسمى بصندوق فارادي Faraday’s Box، كان متحركا على شكل قوسي حول العينة لقياس زوايا التشتت ورصد الإليكترونات المتطايرة.
4. لاحظ دافيسون، بالصدفة، أن هناك قيما عظمى لكثافة الإلكترونات المتشتتة تتغير حسب زاوية العينة، من هنا فقط، بدأ بدراسة التوزيع الزاوي لكثافة الإلكترونات المتطايرة.
"هذه القمم تشير إلى الخاصية الموجية للإلكترونات، ويمكن معالجتها بقانون براغ وحساب الأطوال الموجية المصاحبة للإلكترونات المادية"
وحتى يمكننا فهم هذه العبارة جيدا، ومعرفة كيف دلت هذه التجربة البسيطة، ودراسة منحنيات التوزيع إلى إثبات الخاصية الموجية للجسيمات المادية، دعونا نربط مجموعة من المعلومات والتجارب معا:
هل تذكرون تجربة التداخل التي قام بها يونج ؟ Young’s Double Slip Experiment...
قام يونج بتسليط شعاع ضوئي أحادي اللون على شقين الفاصل بينهما صغير جدا..وقام برصد الأشعة الخارجة من الشقين على شاشة راصد.
ولأن الموجات تلك مكونة من قمم وقيعان فإن التقاء قمة مع قمة أعطاه خطا مضيئا ( قمة + قمة =هدب مضيء، تداخل بناء)..بينما تداخل قمة مع قاع يعطي خطا معتما ( قمة + قاع = هدب معتم، تداخل هدام)..
الشكل التالي يوضح فكرة التداخل بين الموجات (لاحظ أن كل هذا في بعد واحد)..
دعونا لا ننس، أن الموجات لو بقيت تتحرك في اتجاه انطلاقها ذاته، لما حصل لنا تداخل وتكوّن أهداب كما رأينا، ولكن، لأن مبدأ هويغنز يقول أن الموجة تتحرك وتنتشر في كل الاتجاهات، هذا معناه أن الموجة بعدما عبرت الشق تحركت وانتشرت في جميع الاتجاهات، هذا الميل هو ما يسمى بالحيود.
يحدث الحيود عادة عندما تمر موجة من خلال ثقب صغير جدا. .بمعنى، انك لو أردت قياس حيود موجة ذات طول موجي ما، عليك أن تمررها خلال ثقب يتناسب اتساعه مع طول الموجة، وكلما كان الطول الموجي أقل، احتجنا إلى فتحة أصغر للكشف عن حيودها.
هذا ما قام به براغ:
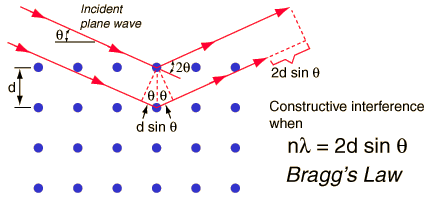
اكتشف رو نتجن أشعة اكس عام 1895، وهي أشعة كهرومغناطيسية طولها الموجي قصير جدا، تقريبا 0.1 نانومتر (10^-9)..ويبدو، كما لك أن تتخيل، أنه من المستحيل الكشف عن حيود أشعة اكس بصناعة شق اتساعه أقل من عشر نانومتر!.
في ذلك الوقت، كان من المعروف أن المسافة الفاصلة بين الذرات في الشبكات البلورية هي في حدود النانومتر..وهنا اقترح Max Von Laue (1879 – 1960) أن منظومة من ذرات بلورة تصلح لأن تكوّن حيودا لموجات اكس في ثلاثة أبعاد.
[align=center][align=center
بدأ براغ دراسة هذا الاقتراح.
نظرا لأن دراسة الحيود في ثلاثة أبعاد معقدة للغاية، سنتحدث عن النتيجة النهائية التي توصل إليها براغ:
وليام هنري براغ ( 1862 ـ 1942) وابنه وليام لورانس براغ (1890 ـ 1971) كانا أول من درس بنية البلورات بالأشعة السينية ( أشعة اكس). وقد نالا جائزة نوبل للفيزياء عام 1915 لعملهما هذا. حيث قاما بإمرار حزمة من أشعة اكس عبر بلورة تسقط نمطا متسقا على صفيحة فوتوغرافية، يدعى المخطط البلوري، ولكل بلورة مخطط خاص بها وهذا المخطط يكشف بنية الذرة الداخلية ونسق ذراتها
قـــانون براغ:
عندما تتشتت أشعة اكس عن شبكة كريستالية، فإن القمم الناتجة عن التشتت والتي يمكن ملاحظتها تتبع القوانين التالية:
1. زاوية السقوط = زاوية التشتت.
2. فرق المسار يساوي عددا صحيحا من الموجات ( موجة، موجتان، ثلاث موجات، يعني لا يصح أن يحصل تداخل بناء يعطي قمة مضيئة من ثلاث موجات وربع مثلا)...
يمكن التعبير عن التداخل البناء بقانون براغ( التداخل البناء هو الذي يعطي أهدابا مضيئة كما في تجربة يونج) وهو:
حيث λ = الطول الموجي،
d = المسافة بين الذرات في الشبكة البلورية،
Ө = زاوية التشتت،
n = عدد صحيح.
سمي القانون بهذا الاسم لأن براغ هو أول من اشتق العلاقة، ولو أمكننا تحديد الزاوية، وحيث أننا نعرف الطول الموجي للأشعة المستخدمة (أشعة اكس) لأمكننا تحديد المسافة الفاصلة بين ذرات البلورة.
الآن، ما الرابط بين ما وجده دافيسون وقانون براغ؟
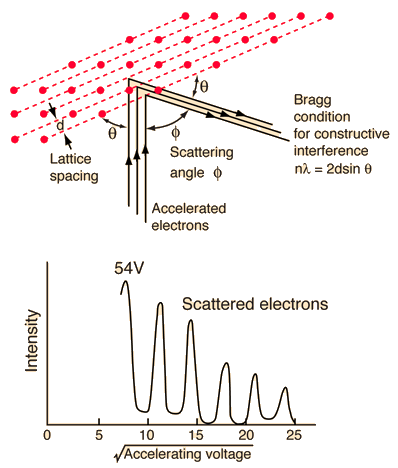
كما قلنا من قبل، قام دافيسون بتوجيه حزمة من الإلكترونات إلى بلورة النيكل. لاحظ أن هناك قيم عظمى لكثافة الإليكترونات المتطايرة تتناسب مع الزاوية. قام بتثبيت الزاوية (50 درجة) وغيّر طاقة الإليكترونات المنبعثة من المدفع تحت فرق جهد 54 فولت، ولاحظ التوزيع البياني الناتج (لاحظوا، القيم العظمى لكثافة الإليكترونات تشابه الهدب المضيئة في تجربة الحيود).
كانت فرضية دي برولي قد وصلت أمريكا كما قلنا، فبدأ دافيسون بالربط:
قانون براغ ( الذي يطبق على الموجات) يقول:
فرضية دي برولي ( التي تتحدث عن السلوك الموجي للإلكترونات)
بتعويض المعادلتين:
وعلى اعتبار معرفة كل القيم، حيث الطاقة محددة مسبقا، وتم تثبيت الزاوية، ومعرفة الفواصل بين الذرات في التركيب البلوري، تم التوصل إلى أن القيم العظمى التي تمكن دافيسون من الحصول عليها، تناظر أطوالا موجية يمكن حسابها من فرضية ديبرولي..
[align
حيود الإليكترونات بواسطة القصدير الأبيض (إلى اليمين)، وحيود الأشعة السينية عن نفس العينة (إلى اليسار
وعلى هذا، تبين تجارب دافيسون وجيرمر، وتجارب طومسون بما لا يدع مجالا للشك بان موجات المادة موجودة بالفعل، وأن أطوالها الموجية "على الأقل للإلكترونات" تحدد بعلاقة دي برولي.
في عام 1929 استطاع استرمان Estermann و شتيرن Stern أن يوضحا بان ذرات الهليوم وجزيئات لهيدروجين تحيد أيضا بشكل يتفق مع نظرية دي برولي.
" تجربة كومبتون أثبتت الخاصية الجسيمية للفوتونات، بينما أثبتت تجربة دافيسون – جيرمر الخصائص الموجية للإلكترونات"
وقد عززت تجاربهما بقوة اعتقادنا بالتحقق العام لموجات المادة حيث أن هذه الجسيمات تتضمن جسيمين جديدين مختلفين تماما عن الإليكترون. وبصرف النظر عن الاختلاف في الكتلة فإن ذرات الهليوم وجزيئات الهيدروجين تختلفان تماما عن الإليكترون في أنهما أنظمة مركبة في حين أن الإليكترون (ربما) يعتبر جسيما أوليا. وعلى هذا توضح التجارب بأن الذرة ككل وأن الجزئ ككل هما موجات، وقد نكون على استعداد الآن لكي نصدق بأنه تحت شروط تجريبية مناسبة سوف يسلك جسم كبير مثل البيانو سلوك الموجة.
وبهذا تكون تجربة دافيسون – جيرمر تجربة فيزيائية اثرت في تطور الفيزياء لان بدون هذه التجربة لبقيت فرضية دبرولي مجرد فكرة قد تكون صحيحة وقد تكون خاطئة، ولكن التجربة اكدت فرضية دبرولي واصبح معروفاً لنا الآن انه كما للإشعاع الكهرومغناطيسي (الفوتونات) خواص موجية وخواص جسيمية فإن للجسيمات (الالكترونات) خواص جسيمية وخواص موجية.












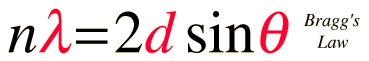
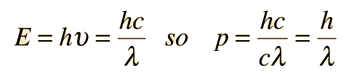
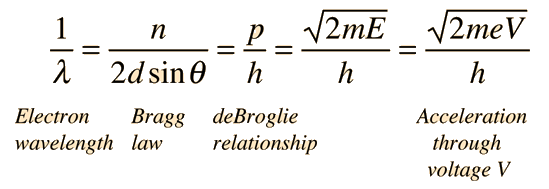


 رد مع اقتباس
رد مع اقتباس