من أهل الدار
تاريخ التسجيل: August-2021
الجنس: أنثى
المشاركات: 2,114 المواضيع: 939
صوتيات:
0
سوالف عراقية:
1
آخر نشاط: 13/March/2024
اكتمال الخريطة المرجعية للجينوم البشري .أصدرت نسختهاالاولى امل جديدًا لفهم بيولوجية
اكتمال الخريطة المرجعية للجينوم البشري
فتحت خريطة الجينوم البشري المرجعية التي صدرت نسختها الأولى مطلع الألفية الثالثة باب أمل جديدًا لفهم بيولوجية الجسم.. غير أن هذه الخريطة كانت غير مكتملة.. كما شابها الكثير من الأخطاء.
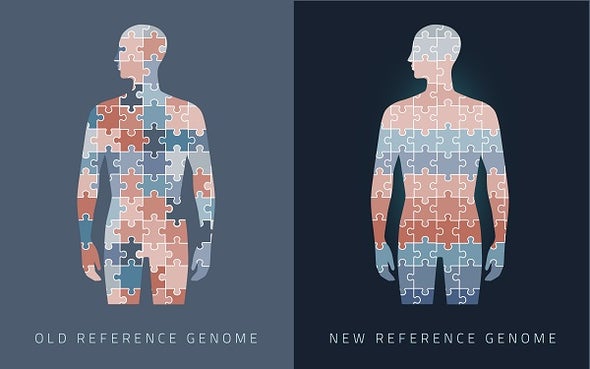
خريطة الجينوم البشري الجديدة توفر تسلسلا مرجعيا خاليا من الفجوات للشفرة الوراثية الخاصة بالبشر Credit: B. Hayes/NIST
يدرك الفرد منا أهمية كتيب الإرشادات المرفق مع أحجية تتكون من ألف قطعة، فتجميع قطع الأحجية بترتيب صحيح يتطلب معرفةً بالشكل المراد تكوينه من هذه الأحجية، والإلمام بالكيفية التي ستضاف بها القطع جنبًا إلى جنب، غير أن كتيب الإرشادات سيكون غير ذي قيمة لو كُتب بلغة تعجز عن فهمها أو قراءة أحرفها.
وبالمثل، فإن معرفة ما يجعل كلًّا منا فريدًا عن غيره يتطلب قراءة المعلومات الوراثية المشفرة داخل الحمض النووي وتحليلها، وتخزن المعلومات الوراثية داخل الـ«دي إن إيه» على هيئة 4 أحرف (قواعد نووية)، وهي: «الأدينين» (A)، و«الثيامين» (T)، و«السايتوزين» (C)، و«الغوانين» (G)؛ إذ يتكون كل جين من تتابُع خاص ومتكرر من هذه الأحرف الأربعة، وتتطلب قراءة هذه الأحرف بتتابُع صحيح تقنياتٍ قادرةً على رصد التسلسل الجيني بكفاءة وفاعلية.
وبالفعل، فقد بدأت جهود رصد التسلسل الجيني عام 1977 عندما طُوِّرت طريقتا «تسلسل ماكسام–جيلبرت» و«تسلسل سانجر» لهذا الغرض، وتَشارك والتر جيلبرت وفريدريك سانجر جائزةَ نوبل في الكيمياء عام 1980؛ لإسهامهما في تحديد تتابُع قواعد الأحماض النووية، ومع نهاية الثمانينيات أصبحت تقنية «تسلسل سانجر الآلية» قادرةً على رصد نحو ألف قاعدة حمض نووي في اليوم الواحد، وبالتوازي مع التطور المستمر الذي شهدته التقنية والحوسبة في ذلك الحين، تبادرت إلى أذهان العلماء فكرة إنشاء خريطة مرجعية للجينوم البشري تحتوي على التسلسل الكامل للأحرف (القواعد النووية) المكونة لجينات البشر.
تسلسل غير مكتمل
ونتاجًا لتلك الجهود العلمية، أُطلِق «مشروع الجينوم البشري» (HGP) عام 1990؛ بغية رصد تسلسل 3 مليارات حرف تُكَوِّن الجينوم الخاص بالبشر، وإضافةً إلى الخريطة الجينية، تضمَّن المشروع أهدافًا أخرى أملت إنشاء خريطة فيزيائية تُسهم في تحديد موقع كلٍّ من هذه التتابُعات -المكونة لكل جين- على الكرُومُوسُومات، كما وضع المشروع رصد التسلسلات الجينية الخاصة ببعض حيوانات التجارب المستخدمة في بحوث الطب الحيوية هدفًا من أهدافه.
وتعهد اتحاد «مشروع الجينوم البشري» عام 1998 بالالتزام بمعايير دولية -عُرفت باسم «مبادئ برمودا» Bermuda principles- تُعنَى بنشر نتائج المشروع، واختصارًا، فقد تعيَّن على المشروع بموجب هذه المعايير:
1) إتاحة تسلسلات القواعد النووية التي يبلغ طولها أكثر من ألف قاعدة خلال 24 ساعة من رصدها.
2) النشر الفوري لنتائج التسلسل الجيني النهائية.
3) إتاحة التسلسل الجيني بأكمله كمشاع مجاني عام يُنتفع به في جهود البحث والتطوير.
ومن ثم فإن هذه المعايير الدولية -إضافةً إلى تدخل الرئيس الأمريكي، بيل كلينتون، ورئيس الوزراء البريطاني، توني بلير، آنذاك- قد أوصدت الباب أمام بعض المحاولات التي كانت تهدف إلى احتكار امتلاك تسلسل الجينوم البشري.
وبفصل تلك الجهود، أفضت المفاوضات التي أُجريت في هذا الصدد إلى تعاوُن جمع بين شركة سيليرا جينومِكس و«مشروع الجينوم البشري»، مما أثمر عن خروج أول مسودة إلى النور عام 2001، وظهرت نتائج المشروع في ورقتين بحثيتين منفصلتين نُشرت إحداهما في دورية «نيتشر» Nature والأخرى في دورية «ساينس» Science.
وعلى الرغم من إتاحة الوصول إلى هاتين الورقتين البحثيتين، إلا أن مطالعة بياناتهما أحيطت ببعض القيود، وقد أُعلن في العام 2003 عن اكتمال المشروع، كما نُشرت النتائج النهائية المدققة في شهر أبريل من العام ذاته في دورية «نيتشر».
غير أن التسلسل الجيني المعلن آنذاك لم يكن تسلسلًا كاملًا لمجمل الجينوم البشري، إذ إن 15 بالمئة منه بقيت غير معروفة، ويرجع السبب في ذلك إلى عجز تقنيات التسلسل الجيني عن رصد أجزاء الحمض النووي التي تحتوي على قواعد نووية مكررة.
عقبات على الطريق
توالت الجهود منذ ذلك الحين لسبر أغوار الجينوم البشري واستكمال أوجه النقص فيه؛ ففي عام 2004، تَوَّج «مشروع الجينوم البشري» جهوده بدراسة أكثر دقةً في رصد التسلسل الجيني، وبنسبة خطأ وصلت إلى قاعدة واحدة لكل 100 ألف قاعدة، وقد كشفت هذه الدراسة عن وجود بعض الأخطاء في مسودة التسلسل الجيني التي نُشرت عام 2001، وأظهرت هذه الدراسة وجود 341 فجوة جينية لم تُرصد في نتائجهم، وعَزَت ذلك إلى عدم قدرة التقنيات المتاحة آنذاك على رصد هذه المناطق.
ومع استمرار تطور تقنيات التسلسل الجيني، استمر العلماء في تعقب هذه المناطق غير المرصودة؛ ففي عام 2013، أقر العلماء خريطة مرجعية للجينوم البشري -حملت اسم (GRCh38)- باعتبارها الخريطة الأكثر دقةً منذ بدء جهود عمليات الرصد.
ويوضح نانا مينساه -باحث الدكتوراة في معهد فرانسيس كريك، وأخصائي المعلوماتية الحيوية في مؤسسة جيز آند سان توماس التابعة لهيئة الخدمات الصحية الوطنية البريطانية- في تصريحات لـ"للعلم" أن "جميع مساعي علوم الوراثة كانت تعتمد على هذه الخريطة، بدءًا من دراسة الطفرات المسببة للأمراض، ووصولًا إلى الدراسات التي تهدف إلى إيجاد علاجات للأمراض الوراثية".
غير أن هذه الخريطة هي الأخرى كانت غير مكتملة، ويُرجع "مينساه" ذلك إلى "عجز التقنية المستخدمة آنذاك عن فك تشفير التسلسلات المتكررة"؛ إذ لم تستطع التقنيات المتاحة حينها سوى قراءة المئات من قواعد الحمض النووي في المرة الواحدة، وبالتالي فإن المناطق التي تحتوي على تسلسلات متكررة ذات أطوال أكبر بكثير من ذاك المدى الذي تستطيع أجهزة الرصد قراءته كانت عصيةً على التتبُّع، ويشبه هذا الأمر التحدي نفسه الذي قد يواجهك عندما تعمل على تجميع أحجية تحتوي على العديد من الأجزاء متماثلة الشكل واللون تمامًا.
وقد مثلت المناطق غير المعروفة في خريطة (GRCh38) المرجعية نسبة 8 بالمئة، وهنا تجدر الإشارة إلى أن بعض هذه المناطق تضطلع بأدوار حيوية، فعلى سبيل المثال، يحتوي القُسَيمُ المَرْكَزِيّ أو ما يُعرف «بالسنترومير» (Centromere) -الذي يؤدي دورًا حيويًّا في عملية الانقسام الخلوي- على تسلسلات متكررة من هذه القواعد النووية، ولذا فإن رصد التسلسل الخاص بتلك المناطق المتكررة يُعد أمرًا بالغ الأهمية.
غير أن تطور التقنية لم يقف عند هذا الحد، إذ أظهرتتقنية رصد التسلسل الجيني الحديثة التي طورتها شركة «باسيفيك بيوساينسز» (Pacific Biosciences) قدرةً على رصد تسلسلات ذات أطوال أكبر في كل عملية رصد تقوم بها، واستطاعت هذه التقنية قراءة ما يقرب من 20 ألفًا من الأزواج القاعدية في المرة الواحدة، وذلك على النقيض من تقنيات التسلسل التقليدية التي تستطيع قراءة بضع مئات من الأزواج القاعدية في المرة الواحدة، وقد أُدخلت بعض التحسينات على التقنية التي طورتها شركة باسيفيك بيوساينسز، والتي أدت إلى الوصول بها إلى دقة رصد بلغت 99.8%، وبمتوسط قدرة على القراءة بلغ 13.5 ألف قاعدة نووية في المرة الواحدة.
خطة طموحة
وبفضل هذه التقنيات المطورة، أخذ اتحاد «تيلومير-تو-تيلومير» Telomere-to-Telomere على عاتقه مهمة رصد فجوات الجينوم البشري التي كانت عصيةً على التتبُّع والتجميع من قبل؛ إذ هدف المشروع -كما هو مشار إليه في اسمه- رصد التتابع الجيني لكل كروموسوم بدءًا من طرفه -والذي يُعرف باسم «القُسَيْم الطَّرَفِيّ أو التيلومير»- وانتهاءً بطرفه المقابل.
وحديثًا، كشف اتحاد علماء "تيلومير-تو-تيلومير" في 6ورقات بحثية منفصلة نُشرت في دورية «ساينس» في أواخر مارس الماضي وأوائل شهر أبريل الجاري تمكُّنهممن رصد تسلسل فجوات الجينوم التي كانت غير معروفة من قبل، كما صححت هذه الدراسات العديد من الأخطاء التي كانت موجودةً في الخرائط الجينية السابقة، ومن ثم فإن هذه الدراسات توفر خريطة مرجعية جديدة أكثر اكتمالًا وأكثر دقة، وقد أُطلق على الخريطة المرجعية الجديدة اسم (T2T-CHM13).
ووفقًا لبعض المصادر التي حصل عليها موقع "للعلم" من المعهد الوطني الأمريكي لأبحاث الجينوم البشري، فإن غالبية القواعد النووية التي تم رصد تسلسلها وتجميعها كانت تتركز في «السنترومير» و«التيلومير»، وكذلك في بعض الأماكن الأخرى المنتشرة على الكروموسومات.

أضافت الخريطة الجديدة نحو ما يقرب من 200 مليون زوج من القواعد النووية إلى سابقتها من الخرائط.
Credit: National Human Genome Research Institute
يوضح جوستن زووك -المدير المشارك المسؤول عن جهود رصد الطفرات في اتحاد «تيلومير-تو-تيلومير»- عبر تصريحاته لموقع "للعلم" أن "هذه الدراسات أضافت نسبة 7% إلى الخريطة المرجعية السابقة، وهو ما يُعد مساويًا لحجم العديد من الكروموسومات"، الأمر ذاته الذي يؤكده نيكولاس ألتيموس، باحث ما بعد الدكتوراة في جامعة كاليفورنيا في بيركلي، والمشارك في أربعٍ من هذه الدراسات في تصريحاته لموقع "للعلم"، قائلًا: "إن الخريطة المرجعية الجديدة تضيف ما يقرب من 200 مليون زوج من القواعد النووية إلى سابقتها من الخرائط".
وتعقيبًا على العقبات التي واجهت استكمال رصد التسلسل الجيني منذ البداية، يوضح "ألتيموس" أن "الحصول على تسلسل كامل للجينوم يتطلب تجزئته إلى قطع صغيرة، ومن ثم تُقرأ تسلسلات هذه القطع وتُجمع معًا، مسترشدين في ذلك بالأماكن التي تتقاطع عندها نهايات هذه القطع"، غير أن هذا الجهد يصبح صعبًا تمامًا عندما تحتوي القطع المجزأة على تسلسلات تعيد نفسها مرارًا وتكرارًا، ومن ثم فإن تلك المناطق المكررة "تفتقر إلى سمات مميزة تساعد على ربط القطع المجزأة بترتيبها الصحيح" كما يقول "ألتيموس"، ولذا استخدم العلماء تقنيات رصد التسلسل الجيني المُحدَّثة، التي تتيح قراءة الآلاف من تتابُعات القواعد النووية في المرة الواحدة.
ونظرًا إلى أن الكروموسوم «واي» المسؤول عن إنتاج الذكور "يحتوي على أكثر من 40 مليون زوج من القواعد النووية المكررة، وهو ما يقارب ثلثي طوله الإجمالي، الأمر الذي يؤثر على كفاءة ربط أجزائه معًا بعد رصد تسلسلها"، على حد قول "ألتيموس"، فقد استخدم العلماء نوعًا منخطوط الخلايا -المعروفة باسم خلايا «رَحَى عُدارِيَّة كاملة» الناتجة من نطاف متطابقة؛ إذ تحتوي خلايا (CHM13) المستخدمة في هذه الخريطة على الكروموسوم «إكس» فقط دون الكروموسوم «واي»، وهو ما يعني أن التقنية الحديثة سترصد التسلسلات الجينية الموجودة في نسخ متماثلة من الكروموسومات آتية جميعها من خلية الأم، وذلك بدلًا من أن تعاني هذه التقنيات مشقةً في التفرقة بين نوعين من الكروموسومات الجنسية الآتية من الأم والأب.
والكروموسوم Y هو أحد اثنين من الكروموسومات الجنسية لدى الثدييات، والآخر هو الكروموسوم إكس، ولأن كروموسوم Y هو فقط الذي ينتقل من الأب إلى الأبناء، فإن وجوده أو غيابه هو ما يحدد جنس المولود في التكاثر الجنسي لدى الثدييات، ومن ضمنها البشر والعديد من الحيوانات الأخرى.
آفاق مستقبلية واعدة
وتعقيبًا على أهمية هذه الخريطة المرجعية الجديدة، يقول "مينساه"، أخصائي المعلوماتية الحيوية غير المشارك في هذه الدراسات: "إن تحليل البيانات الجينية عامةً يتطلب مقارنتها بخريطة مرجعية، ومن ثم فإن هذه الخريطة المُحَسَّنة ستعين على تحديد التسلسل والموقع الصحيح لأي عينة جينية مجهولة نعمل على دراستها".
ويذكر "مينساه" أن "الخريطة المرجعية الجديدة تعرفت على ملايين الطفرات التي أخطأتها الخرائط السابقة، ومن ثم فإنها ستدفع باتجاه إعادة تحليل البيانات القديمة، مما قد ينتج عنه رؤى جديدة".
وهنا تجدر الإشارة إلى افتقار الخريطة المرجعية الجديدة إلى التسلسل الخاص بالكروموسوم «واي»؛ إذ إنها اعتمدت على خلايا تحتوي على الكروموسوم «إكس» فقط، وهو ما يصفه "مينساه" بأنه "قد يحد من قدرتنا على فهم عدد من الأمراض المرتبطة بالجنس"، غير أن "ألتيموس" أشار إلى أنهم "في طور الانتهاء من رصد التسلسل الخاص بالكروموسوم «واي»، معتمدين في ذلك على نوع آخر من الخلايا"؛ فمن المتوقع أن تصدر الدراسة المتعلقة بهذا الصدد قريبًا، وفقًا لما ذكره "ألتيموس".
من جانبه، يشير "مينساه" إلى "وجود بعض العقبات الفنية التي عاقت اكتمال هذه الخريطة المرجعية، تتمثل في غياب بضع مئات من الجينات التي تم رصدها من قبل في خريطة (GRCh38)"، معتقدًا أن "السبب في ذلك يرجع إلى قلة نُسَخِ هذه الجينات أو إلى افتقارها للمواءمة مع الخلايا المستخدمة في الخريطة المرجعية الجديدة".
وإضافةً إلى ذلك، فإن وجود جينوم مرجعي يخص عرقًا واحدًا دون غيره لا يُعد كافيًا لحصر جميع الاختلافات البشرية؛ إذ يشير "مينساه" إلى أن "الخريطة الجديدة تخص فردًا ذا أصول أوروبية"، وقد تُظهر هذه الخريطة بعض الشذوذ أو الانحرافات الجينية لو قورنت بأشخاص ذوي عِرقٍ مغاير، ومن ثم فإن هناك حاجة ملحَّة إلى رسم خرائط مرجعية أخرى تخص أفرادًا وأعراقًا مختلفة، وهو الأمر الذي يعكف على دراسته اتحاد الجمعية المرجعية للجينوم البشري، كما ذكر "زووك".
وبطبيعة الحال، ستُسهم هذه الخريطة الجديدة في فهم المناطق المعقدة من الجينوم التي تعذَّر الوصول إليها من قبل؛ إذ يرى "مينساه" أن "الجينات الجديدة التي تعرفت عليها هذه الخريطة قد يحمل أحدها بين طياته حلقةً مفقودةً تساعدنا على فهم بيولوجيا الأمراض وتطورها".
وبالإضافة إلى ذلك، كشفت هذه الخريطة عن مناطق الجينوم التنظيمية غير المُشَفرة، والتي قد يوفر استهدافها بواسطة العلاجات الجديدة أملًا جديدًا للسيطرة على بعض الأمراض، كما هو الحال في العلاجات فوق الجينية، وهو ما يؤكده "مينساه" قائلًا: "قد نرى العديد من الدراسات التي تهتم بهذه المناطق خلال السنوات المقبلة"، الأمر الذي سيساعد على فهم الأمراض بشكل أفضل وعلى إيجاد علاجات جديدة وناجعة لها، كما أن هذه الخريطة المرجعية ستساعد على المضي قدمًا بوتيرة متسارعة نحو مزيد من جهود الطب التشخيصي.






 رد مع اقتباس
رد مع اقتباس