كيف تغير تقنية “كريسبر” أبحاث السرطان وعلاجه – ترجمة المهندس صادق علي القطري
How CRISPR Is Changing Cancer Research and Treatment
(المعهد الوطني للسرطان – NCI)
منذ أن أدرك العلماء أن التغيرات في الحمض النووي تسبب السرطان، كانوا يبحثون عن طريقة سهلة لتصحيح تلك التغييرات عن طريق التلاعب بالحمض النووي. على الرغم من تطوير العديد من طرق التحرير الجيني على مر السنين، إلا أن أيا منها لم يكن مناسبًا حقًا للحصول على تقنية سريعة وسهلة ورخيصة.
ولكن حدث تغيير في قواعد اللعبة في عام 2013، عندما أظهر العديد من الباحثين أن أداة تعديل الجينات تسمى كريسبر يمكن أن تغير الحمض النووي للخلايا البشرية مثل مقص دقيق للغاية وسهل الاستخدام.
تعد كريسبر أداة تحرير جينات عالية الدقة تعمل على تغيير أبحاث السرطان وعلاجه. حقوق الصورة: (Ernesto del Aguila III) ، المعهد القومي لبحوث الجينوم البشري
لقد أحدثت الأداة الجديدة ثورة في عالم الأبحاث، مما أدى إلى تغيير ملحوظ في الخط الفاصل بين الممكن والمستحيل. بمجرد أن شق كريسبر طريقه إلى أرفف ومجمدات المعامل حول العالم، انتهز الباحثون في مجال السرطان فرصة استخدامه.
قال جيري لي، دكتوراه من قسم بيولوجيا السرطان في المعهد الوطني للسرطان: “أصبحت كريسبر منهجية سائدة مستخدمة في العديد من دراسات بيولوجيا السرطان بسبب ملاءمة هذه التقنية”.
الآن، تنتقل تقنية كريسبر من أطباق المختبر إلى تجارب الأشخاص المصابين بالسرطان. في دراسة صغيرة، على سبيل المثال، اختبر الباحثون علاجًا للسرطان يشمل الخلايا المناعية التي تم تعديلها بواسطة كريسبر لتعقب السرطان ومهاجمته بشكل أفضل.
على الرغم من كل هذه الإثارة، كان العلماء يتقدمون بحذر، ويشعرون بنقاط القوة والمزالق للأداة، ويضعون أفضل الممارسات، ويناقشون العواقب الاجتماعية والأخلاقية لتعديل الجينات على البشر.
كيف تعمل تقنية كريسبر؟
مثل العديد من التطورات الأخرى في العلوم والطب، استلهمت تقنية كريسبر من الطبيعة. في هذه الحالة، تم استعارة الفكرة من آلية دفاع بسيطة موجودة في بعض الميكروبات، مثل البكتيريا.
لحماية نفسها من الغزاة مثل الفيروسات، تلتقط هذه الميكروبات مقتطفات من الحمض النووي للدخيل وتخزنها بعيدًا على شكل شرائح تسمى (CRISPRs)، أو تتجمع بشكل منتظم مع تكرار قصير متناوب. إذا حاولت نفس الجرثومة الهجوم مرة أخرى، فإن قطع الحمض النووي (التي تحولت إلى قطع قصيرة من الحمض النووي الريبي) تساعد إنزيمًا يسمى كاس في العثور على الحمض النووي للغزاة وتقطيعه.
بعد اكتشاف نظام الدفاع هذا، أدرك العلماء أنه يمتلك مقومات أداة متعددة الاستخدامات لتحرير الجينات. في غضون بضع سنوات، نجحت مجموعات متعددة في تكييف النظام لتعديل أي جزء تقريبًا من الحمض النووي، أولاً في خلايا الميكروبات الأخرى، ثم في النهاية في الخلايا البشرية.
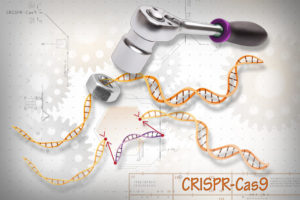
يتكون (CRISPR) من دليل (RNA) (جهاز استهداف RNA، أرجواني) وإنزيم (Cas) (أزرق). عندما يتطابق دليل الحمض النووي الريبي مع الحمض النووي المستهدف (برتقالي) ، يقطع كاس الحمض النووي. يمكن بعد ذلك إضافة جزء جديد من الحمض النووي (أخضر). الائتمان: المعهد الوطني للعلوم الطبية العامة، المعاهد الوطنية للصحة.
لماذا تعد تقنية كريسبر صفقة كبيرة؟
يعتبر العلماء أن تقنية كريسبر تغير قواعد اللعبة لعدد من الأسباب. ربما يكون أكبرها أن تقنية (CRISPR) سهلة الاستخدام، لا سيما بالمقارنة مع أدوات تحرير الجينات القديمة.
“في السابق، لم يكن بإمكان سوى عدد قليل من المعامل في العالم صنع الأدوات المناسبة [لتحرير الجينات]. الآن، حتى طالب المدرسة الثانوية يمكنه إجراء تغيير في جينوم معقد “باستخدام كريسبر، كما قال أليخاندرو تشافيز، دكتوراه ، أستاذ مساعد في جامعة كولومبيا قام بتطوير العديد من أدوات كريسبر الجديدة.
كما أن تقنية (CRISPR) قابلة للتخصيص تمامًا. يمكنه تعديل أي جزء تقريبًا من الحمض النووي ضمن 3 مليارات حرف من الجينوم البشري، وهو أكثر دقة من أدوات تحرير الحمض النووي الأخرى.
ويعد تحرير الجينات باستخدام تقنية كريسبر أسرع كثيرًا. مع الأساليب القديمة، “عادةً ما يستغرق الأمر عامًا أو عامين لإنشاء نموذج فأر معدل وراثيًا، إذا كنت محظوظًا”، قال الدكتور لي. ولكن الآن مع تقنية كريسبر، يمكن للعالم إنشاء نموذج معقد للفأر في غضون بضعة أشهر، على حد قوله.
ميزة أخرى هي أنه يمكن توسيع نطاق تقنية كريسبر بسهولة. يمكن للباحثين استخدام مئات من (RNAs) للتلاعب وتقييم مئات أو آلاف الجينات في وقت واحد. غالبًا ما يستخدم باحثو السرطان هذا النوع من التجارب لانتقاء الجينات التي قد تجعل الأدوية أهدافًا جيدة وكمكافأة إضافية، “إنها بالتأكيد أرخص من الطرق السابقة”، كما أشار الدكتور شافيز.
ما هي قيود كريسبر؟
مع كل مزاياها التي تتفوق على أدوات تحرير الجينات الأخرى، أصبحت تقنية كريسبر نقطة انطلاق للعلماء الذين يدرسون السرطان. هناك أمل أيضًا في أن يكون لها مكان في علاج السرطان أيضًا. لكن تقنية كريسبر ليست مثالية، وقد جعلت سلبياتها العديد من العلماء حذرين بشأن استخدامها في البشر.
تتمثل إحدى المآزق الرئيسية في أن تقنية (CRISPR) تقطع الحمض النووي أحيانًا خارج الجين المستهدف – وهو ما يُعرف بالتحرير “خارج الهدف”. يشعر العلماء بالقلق من أن مثل هذه التعديلات غير المقصودة يمكن أن تكون ضارة ويمكن أن تتحول إلى خلايا سرطانية، كما حدث في دراسة عام 2002 للعلاج الجيني.
أوضح الدكتور شافيز: “إذا بدأت [كريسبر] في تحطيم أجزاء عشوائية من الجينوم، يمكن للخلية أن تبدأ في تجميع الأشياء معًا بطرق غريبة حقًا، وهناك بعض القلق من تحول ذلك إلى سرطان”. وأضاف أنه من خلال تعديل هياكل (Cas) ودليل (RNA)، قام العلماء بتحسين قدرة (CRISPR) على قطع الهدف المقصود فقط.
هناك عقبة أخرى محتملة تتمثل في إدخال مكونات كريسبر في الخلايا والطريقة الأكثر شيوعًا للقيام بذلك هي اختيار أحد الفيروسات للقيام بهذه المهمة. بدلاً من نقل الجينات المسببة للمرض، يتم تعديل الفيروس ليحمل جينات لتوجيه (RNA) و (Cas).
انزلاق كريسبر في الخلايا المزروعة في المختبر شيء واحد. لكن إدخاله إلى خلايا في جسم الإنسان هو قصة أخرى. يمكن لبعض الفيروسات المستخدمة في نقل كريسبر أن تصيب أنواعًا متعددة من الخلايا، لذلك، على سبيل المثال، قد ينتهي بهم الأمر بتعديل خلايا العضلات عندما كان الهدف هو تعديل خلايا الكبد.
يستكشف الباحثون طرقًا مختلفة لضبط توصيل كريسبر لأعضاء أو خلايا معينة في جسم الإنسان. يختبر البعض فيروسات تصيب عضوًا واحدًا فقط، مثل الكبد أو الدماغ. ابتكر البعض الآخر هياكل صغيرة تسمى كبسولات نانوية مصممة لتوصيل مكونات كريسبر إلى خلايا معينة.
نظرًا لأن تقنية (CRISPR) قد بدأت للتو في الاختبار على البشر، فهناك أيضًا مخاوف بشأن كيفية تفاعل الجسم – ولا سيما الجهاز المناعي – مع الفيروسات التي تحمل تقنية (CRISPR) أو مكونات (CRISPR) نفسها.
يتساءل البعض عما إذا كان الجهاز المناعي يمكنه مهاجمة كاس (إنزيم بكتيري غريب عن أجسام الإنسان) ويدمر الخلايا المحررة بتقنية كريسبر. قبل عشرين عاما، توفي مريض بعد أن شن جهازه المناعي هجوما هائلا ضد الفيروسات التي تحمل العلاج الجيني الذي تلقاه. ومع ذلك، فإن الأساليب الأحدث القائمة على تقنية كريسبر تعتمد على الفيروسات التي تبدو أكثر أمانًا من تلك المستخدمة في العلاجات الجينية القديمة.
مصدر قلق كبير آخر هو أن تعديل الخلايا داخل الجسم يمكن أن يؤدي عن طريق الخطأ إلى إحداث تغييرات في الحيوانات المنوية أو خلايا البويضات التي يمكن أن تنتقل إلى الأجيال القادمة. ولكن في جميع الدراسات البشرية الجارية تقريبًا التي تتضمن تقنية كريسبر، تتم إزالة خلايا المرضى وتحريرها خارج أجسامهم. قال الدكتور شافيز إن هذا النهج “خارج الجسم الحي” يعتبر أكثر أمانًا لأنه يتم التحكم فيه أكثر من محاولة تحرير الخلايا داخل الجسم.
ومع ذلك، فإن إحدى الدراسات الجارية تختبر تحرير الجينات بتقنية كريسبر مباشرة في عيون الأشخاص المصابين بمرض وراثي يسبب العمى، يسمى ليبر الخلقي.
أول تجربة سريرية لـ (CRISPR) للسرطان
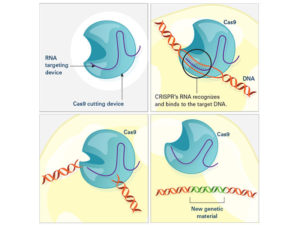
تم إطلاق أول تجربة في الولايات المتحدة لاختبار علاج السرطان المصنوع بتقنية كريسبر في عام 2019 في جامعة بنسلفانيا. الدراسة، التي تم تمويلها جزئيًا من قبل المعهد القومي للسرطان، تختبر نوعًا من العلاج المناعي يتم فيه تعديل الخلايا المناعية للمرضى وراثيًا “لرؤية” السرطان وقتله بشكل أفضل.
أول تجربة لـ (CRISPR) للمرضى المصابين بالسرطان تم اختبار الخلايا التائية التي تم تعديلها “لرؤية” السرطان بشكل أفضل وقتله. تم استخدام كريسبر لإزالة ثلاثة جينات: اثنان يمكن أن يتداخلان مع مستقبلات NY-ESO-1 والآخر يحد من قدرات الخلايا على قتل السرطان. الائتمان: المعهد الوطني للسرطان.
مزيد من الدراسات حول علاجات كريسبر القادمة
في حين أن دراسة خلايا (NYCE T) كانت أول تجربة لعلاج السرطان المستند إلى (CRISPR)، فمن المحتمل أن يكون هناك المزيد في المستقبل.
قال د. ستادماور “كانت هذه [التجربة] حقًا إثباتًا للمبدأ، وجدوى، وأمرًا آمنًا يفتح الآن عالم تحرير (CRISPR) بأسره وتقنيات أخرى لتحرير [الجينات] على أمل صنع الجيل التالي من العلاجات”.
دراسات سريرية أخرى لعلاجات السرطان من صنع كريسبر جارية بالفعل. تختبر بعض التجارب علاجات (CAR T-cell) المصممة بتقنية (CRISPR)، وهو نوع آخر من العلاج المناعي. على سبيل المثال، تختبر إحدى الشركات خلايا (CAR T) المصممة بتقنية (CRISPR) لدى الأشخاص المصابين بسرطان الخلايا البائية والأشخاص المصابين بالورم النخاعي المتعدد.
لا يزال هناك الكثير من الأسئلة حول جميع الطرق التي يمكن أن تستخدم بها تقنية كريسبر في أبحاث السرطان وعلاجه. لكن هناك شيء واحد مؤكد: المجال يتحرك بسرعة لا تصدق، وتظهر التطبيقات الجديدة للتكنولوجيا باستمرار.
قال الدكتور لي: “لا يزال الناس يحسنون أساليب كريسبر”. “إنها منطقة نشطة جدًا للبحث والتطوير. أنا متأكد من أن (CRISPR) سيكون لها تطبيقات أوسع في المستقبل”.
المصدر:
https://www.cancer.gov/news-events/c...arch-treatment





 رد مع اقتباس
رد مع اقتباس