قبل وقت قصير من نهاية عام 2015 ، قدّم الاتحاد الدولي للمواد الكيميائية ، IUPAC ، اعلانا كان كالقنبلة في عالم الكيمياء. بعد عدة سنوات من مراجعة ودراسة الابحاث ، أضاف الـ IUPAC رسميا أربعة عناصر جديدة تحمل التسلسل 113 و 115 و 117 و 118 إلى الجدول الدوري.
شعر الياباني الحائز على جائزة نوبل في الكيمياء وجائزة الملك فيصل العالمية في العلوم ريوجي نويوري ، والذي كان وراء اكتشاف العنصر رقم 113 ، بسعادة غامرة من تلك الأخبار, "بالنسبة للباحثين ، إنها ذات قيمة أكبر من الميدالية الذهبية الأولمبية" ، كما قال نويوري عن اكتشاف العناصر الجديدة. وهو بالفعل حدث كبير, فالعناصر الأربعة الجديدة هي أول العناصر التي تضاف إلى الجدول الدوري منذ عام 2011. ولأول مرة في التاريخ ، اكتمل الجدول الدوري الآن.
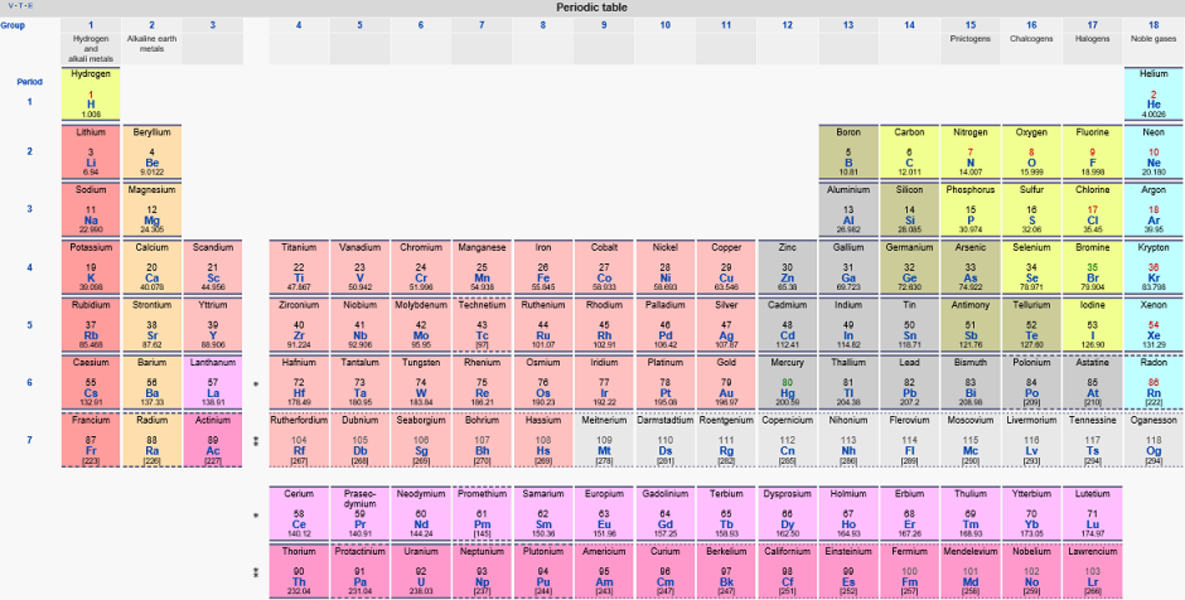
كان الكيميائي الروسي ديمتري مندلييف أول من نشر جدولا دوريا معروفا في عام 1869، وقد تم تطويره بشكل أساسي لتوضيح الاتجاهات الدورية للعناصر المعروفة آنذاك والتي لم تكن أكثر من 63 عنصرا. اكتشف مندلييف أن كل بعض العناصر لها خصائص مشتركة مع غيرها عندما قام بترتيبها وفقا لوزنها. ثم رتب تلك العناصر في 18 مجموعة - الأعمدة الرأسية - وفقا لأوجه التشابه في الخصائص الكيميائية للمواد. و أفقيا ، تم ترتيب العناصر في سبع دورات ، والتي تشير إلى عددإلكترونات التكافؤ .
ترك الكيميائي الروسي خانات فارغة في جدوله الدوري للعناصر التي لم يتم اكتشافها بعد. وعندما أكتشفت عناصر جديدة تم ادراجها في تلك الخانات وفقا لخصائصه.
أصبح الجدول الدوري معروفا على نطاق واسع. وليس الأمر الّا مسألة وقت فقط قبل أن يتم توسيع الجدول الدوري بشكل أكبر. في جميع أنحاء العالم ، يكافح الكيميائيون ليكونوا أول من يوسع الجدول الدوري للعنصر 119.
لم يتم تقديم تفسير نظري لخصائص العناصر حتى عام 1913 ، عندما قدم الفيزيائي الدنماركي نيلز بور نظريته الذرية. بحسب نظرية بور أن الذرة تتكون من نواة تحتوي على عدد من البروتونات ومثلها من النيوترونات, وعلى ضوء تلك الجزيئات يتحدد وزن الذرة. كما ان الذرات لها عدد ذري متصاعد يعكس عدد البروتونات في النواة.
أخف عنصر في الجدول الدوري هو الهيدروجين الذي يحتوي على بروتون واحد في النواة وبالتالي فان عدد الذري هو 1. العنصر الطبيعي الذي يحتوي على أكبر عدد من البروتونات هو البلوتونيوم وله العدد الذري 94. تمت إضافة البلوتونيوم إلى الجدول الدوري جنبا إلى جنب مع النبتونيوم (رقم 93) في عام 1940 عندما قام باحثون في مختبر لورنس بيركلي الوطني بانتاج البلوتونيوم بقذف نظير الديتيريوم, الذي يسمى بالهيدروجين الثقيل, على كتلة من اليورانيوم في المفاعلات النووية. وبعد عدة سنوات فقط تم العثور على التواجد الطبيعي للعنصرين, البلوتونيوم والنبتونيوم, بكميات صغيرة جدا.
أتاح الجدول الدوري تنظيم العناصر بطريقة تجعل من السهل رؤية كيفية تفاعل المواد المختلفة مع بعضها البعض. على سبيل المثال ، الصوديوم شديد الانفجار والكلور شديد السمية ، ولكن عندما يشكل العنصران معا كلوريد الصوديوم ، يصبحان مركبا كيميائيا صالح للاستخدام, ملح الطعام.
كانت معرفة تفاعل العناصر ذات أهمية كبيرة لتطوير العديد من التقنيات والمواد الجديدة وكذلك انتاج الأدوية والغذاء. تستخدم العديد من المنتجات عالية التقنية التي أصبحت جزءا من حياتنا اليومية خصائص خاصة لعناصر معينة, من الشاشات المسطحة والخلايا الشمسية (الإنديوم والغاليوم) إلى الهواتف الذكية (التنتالوم) وخلايا الوقود (البلاتين). العنصر الأكثر أهمية في جميع الأجهزة الإلكترونية الحديثة هو السيليكون. السيليكون هو ما يسمى بأشباه الموصلات ، مما يعني أن له موصلية كهربائيةما بين المعدن (مثل النحاس) والعازل (مثل الزجاج). لقد أرست أشباه الموصلات الأساس للترانزستورات والخلايا الشمسية ومصابيح الثنائية باعثة الضوء (LED) والدوائر المتكاملة الرقمية والتناظرية في أجهزة الكمبيوتر وفي الهواتف.
العديد من العناصر المستخدمة في الإلكترونيات نادرة جدا لدرجة أنها لا تستطيع مواكبة الإنتاج المتزايد في المستقبل. قد يكون الإنتاج الاصطناعي للعناصر في الجدول الدوري (من الرقم 94 فصاعدا) قادرا على توفير ما نحتاجه من تلك العناصر.
تُستخدم العناصر الثقيلة في كل شيء بدءا من أجهزة إنذار الحريق (الأمريسيوم) وحتى الأسلحة النووية (البلوتونيوم) ، ولكن العناصر فائقة الثقل المُنتَجة صناعيا تتحلل في جزء من الثانية وبالتالي لا يمكن استخدامها في الممارسات العملية. ولا نعرف متى ننجح في جعل العناصر فائقة الثقل مستقرة بدرجة كافية لاستخدامها في حياتنا ضمن تطبيقات عملية.
حصري لمنتديات درر العراق
في سلسلة المواضيع القادمة سنتكلم عن بعض العناصر المهمة, كل عنصر على حدة





 رد مع اقتباس
رد مع اقتباس